Номер 709, страница 118 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 5. Химия растворов. Параграф 26. Понятие о водородном показателе (рН) раствора - номер 709, страница 118.
№709 (с. 118)
Условие. №709 (с. 118)
скриншот условия

709. Какое число ионов водорода содержится в растворе сильной кислоты НА с молярной концентрацией $10^{-5} \text{ моль/дм}^3$ и объёмом $100 \text{ см}^3$? Чему равен $pH$ этого раствора?
Решение. №709 (с. 118)
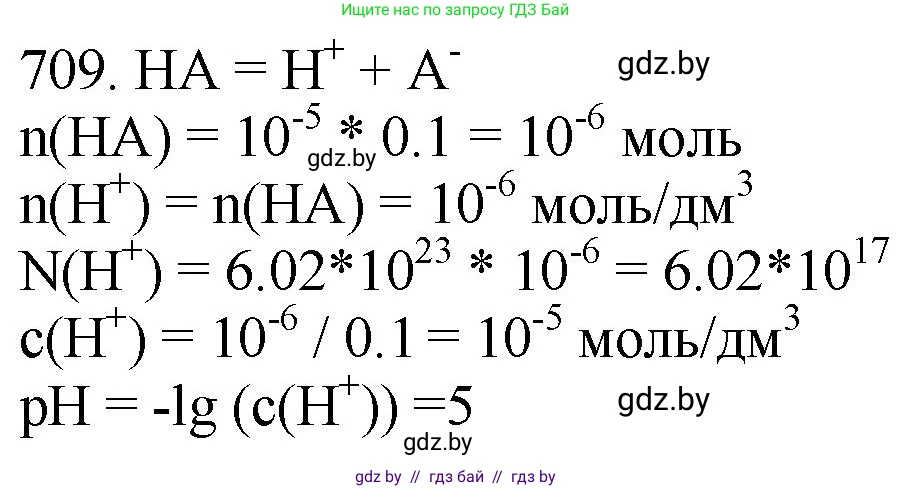
Решение 3. №709 (с. 118)
Дано:
Сильная кислота HA
Молярная концентрация $C_{HA} = 10^{-5}$ моль/дм³
Объем раствора $V = 100$ см³
Постоянная Авогадро $N_A \approx 6.022 \cdot 10^{23}$ моль⁻¹
$C_{HA} = 10^{-5} \frac{\text{моль}}{\text{дм}^3} = 10^{-5} \frac{\text{моль}}{10^{-3} \text{ м}^3} = 10^{-2} \frac{\text{моль}}{\text{м}^3}$
$V = 100 \text{ см}^3 = 100 \cdot (10^{-2} \text{ м})^3 = 100 \cdot 10^{-6} \text{ м}^3 = 10^{-4} \text{ м}^3$
Найти:
$N(H^+)$ — число ионов водорода
$pH$ — водородный показатель раствора
Решение:
Задача решается в два этапа: сначала находим число ионов водорода, затем — pH раствора.
1. Расчет числа ионов водорода
Поскольку HA является сильной кислотой, она полностью диссоциирует в водном растворе на ионы. Уравнение диссоциации имеет вид:
$HA \rightarrow H^+ + A^-$
Из уравнения следует, что концентрация ионов водорода $[H^+]$ в растворе равна исходной концентрации кислоты $C_{HA}$:
$[H^+] = C_{HA} = 10^{-5}$ моль/дм³
Для дальнейших расчетов переведем объем раствора из см³ в дм³, зная, что 1 дм³ = 1000 см³:
$V = 100 \text{ см}^3 = 0.1 \text{ дм}^3$
Теперь можно найти количество вещества (число молей) ионов водорода $n(H^+)$ в заданном объеме раствора:
$n(H^+) = [H^+] \cdot V = 10^{-5} \frac{\text{моль}}{\text{дм}^3} \cdot 0.1 \text{ дм}^3 = 10^{-6} \text{ моль}$
Чтобы найти абсолютное число ионов $N(H^+)$, умножим количество вещества на постоянную Авогадро $N_A$:
$N(H^+) = n(H^+) \cdot N_A = 10^{-6} \text{ моль} \cdot 6.022 \cdot 10^{23} \text{ моль}^{-1} = 6.022 \cdot 10^{17}$
Ответ: в растворе содержится $6.022 \cdot 10^{17}$ ионов водорода.
2. Расчет pH раствора
Водородный показатель (pH) определяется как отрицательный десятичный логарифм от концентрации ионов водорода:
$pH = -\lg[H^+]$
Подставим известное значение концентрации $[H^+]$:
$pH = -\lg(10^{-5})$
Согласно свойству логарифма ($ \lg(10^x) = x $), получаем:
$pH = -(-5) = 5$
Ответ: pH этого раствора равен 5.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 709 расположенного на странице 118 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №709 (с. 118), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














