Номер 2, страница 268 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава VII. Металлы. Параграф 48. Алюминий и его соединения - номер 2, страница 268.
№2 (с. 268)
Условия. №2 (с. 268)
скриншот условия
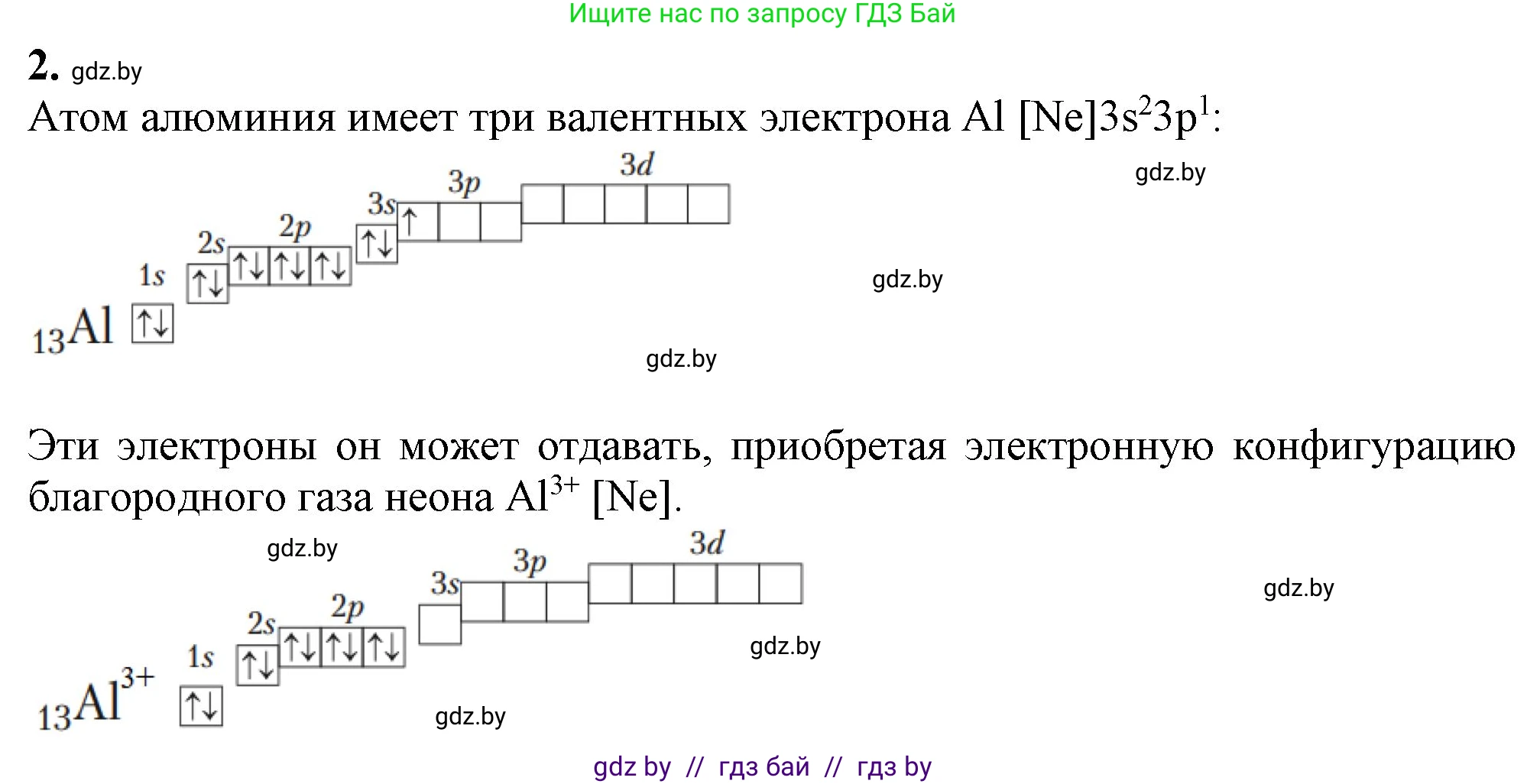
2. Сравните электронное строение атома алюминия и его трёхзарядного катиона.
Решение. №2 (с. 268)
Решение 2. №2 (с. 268)
Для сравнения электронного строения атома алюминия и его трехзарядного катиона необходимо рассмотреть их электронные конфигурации, количество протонов, электронов, электронных слоев и другие характеристики.
Электронное строение атома алюминия (Al)
Алюминий ($Al$) — это химический элемент 3-го периода, 13-й группы (IIIА группы) периодической системы. Его порядковый номер — 13.
Из этого следует:
Заряд ядра атома алюминия равен $+13$ (в ядре 13 протонов).
Атом является электронейтральной частицей, поэтому число электронов равно числу протонов, то есть 13.
Электроны расположены на трех энергетических уровнях (так как элемент находится в 3-м периоде).
Электронная формула (конфигурация) атома алюминия записывается следующим образом:
$_{13}Al: 1s^22s^22p^63s^23p^1$
Распределение по слоям: 2, 8, 3. На внешнем, третьем энергетическом уровне находятся 3 валентных электрона. Этот уровень является незавершенным.
Электронное строение трехзарядного катиона алюминия ($Al^{3+}$)
Атом алюминия, как типичный металл, стремится к завершению внешнего электронного слоя путем отдачи валентных электронов. Он отдает 3 электрона со своего внешнего уровня и превращается в положительно заряженный ион (катион) с зарядом $+3$.
Процесс ионизации: $Al^0 - 3e^- \rightarrow Al^{3+}$
Характеристики катиона $Al^{3+}$:
Число протонов в ядре не изменяется и равно 13.
Число электронов становится $13 - 3 = 10$.
Эти 10 электронов располагаются на двух энергетических уровнях.
Электронная формула катиона алюминия:
$_{13}Al^{3+}: 1s^22s^22p^6$
Распределение по слоям: 2, 8. Внешний электронный слой (второй) у катиона $Al^{3+}$ является завершенным (содержит 8 электронов), что соответствует стабильной электронной конфигурации инертного газа неона ($Ne$).
Сравнение атома $Al$ и катиона $Al^{3+}$
Общее:
Атом и катион алюминия имеют одинаковый заряд ядра ($+13$), так как содержат одинаковое количество протонов (13).
Различия:
1. Число электронов: атом $Al$ имеет 13 электронов, катион $Al^{3+}$ — 10 электронов.
2. Заряд: атом $Al$ электронейтрален (заряд 0), катион $Al^{3+}$ имеет заряд $+3$.
3. Количество электронных слоев: атом $Al$ имеет 3 электронных слоя, катион $Al^{3+}$ — 2 электронных слоя.
4. Строение внешнего слоя: у атома $Al$ внешний слой ($3s^23p^1$) незавершен, у катиона $Al^{3+}$ внешний слой ($2s^22p^6$) завершен, что делает его более стабильным.
5. Радиус: радиус катиона $Al^{3+}$ (около 53 пм) значительно меньше радиуса атома $Al$ (около 143 пм). Это связано с уменьшением числа электронных слоев и более сильным притяжением оставшихся электронов к ядру.
Ответ:
Атом алюминия ($Al$) и его трехзарядный катион ($Al^{3+}$) имеют одинаковое число протонов в ядре (13), но различаются по числу электронов (13 у атома и 10 у катиона). Следствием этого являются различия в их свойствах: атом $Al$ электронейтрален, имеет 3 электронных слоя с незавершенным внешним слоем ($3s^23p^1$), в то время как катион $Al^{3+}$ имеет заряд $+3$, 2 электронных слоя и стабильную, завершенную внешнюю электронную оболочку ($2s^22p^6$), аналогичную атому неона. Катион алюминия имеет значительно меньший радиус по сравнению с нейтральным атомом.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 268 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 268), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













