вариант 2, страница 6, часть 1 - гдз по химии 8 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 1
Цвет обложки: розовый с пробирками
ISBN: 978-985-597-607-4
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Часть 1. Практические работы. Практическая работа 1 - страница 6.
вариант 2 (с. 6)
Условие. вариант 2 (с. 6)
скриншот условия



I этап. Измерение массы и объемов с последующим расчетом
| Задание | Выполнение опыта | Расчет |
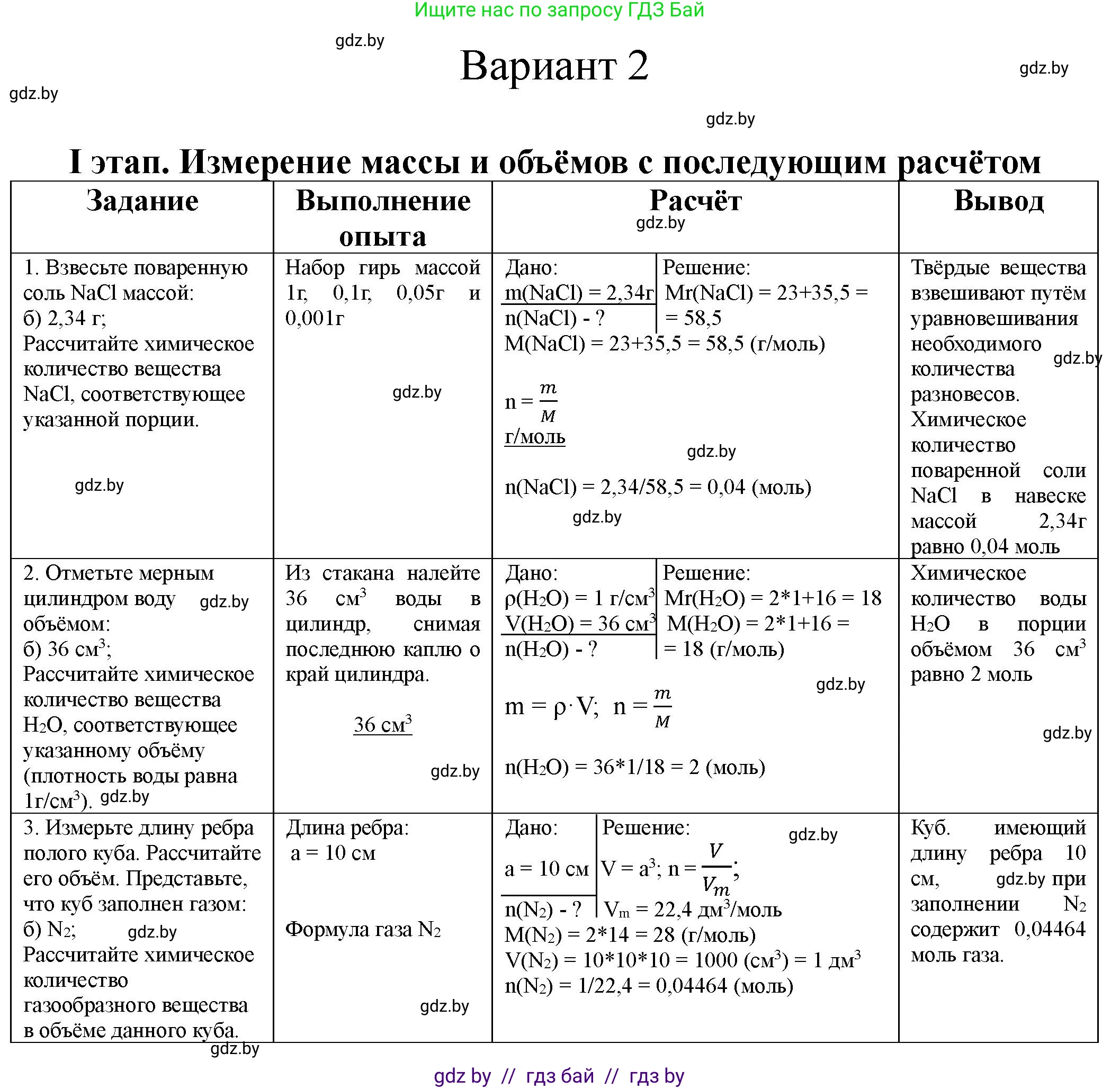
1. Взвесьте поваренную соль NaCl массой: а) 1,17 г; б) 2,34 г; Рассчитайте химическое количество вещества NaCl, соответствующее указанной порции. | Приведите весы с пустым стаканчиком (бюксом) в равновесие. Положите на вторую чашу весов набор гирь массой _______. Осторожно насыпьте порцию вещества. 
| Дано: $m(NaCl) = ...$ $n(...) = ?$ $n = \frac{m}{M}$ $n(NaCl) = $ |
2. Отмерьте мерным цилиндром воду объемом: а) 10 см$^3$; б) 36 см$^3$; в) 27 см$^3$; г) 80 см$^3$. Рассчитайте химическое количество вещества H$_2$O, соответствующее указанному объему (плотность воды равна 1 г/см$^3$). | Из стакана налейте ______ см$^3$ воды в цилиндр, снимая последнюю каплю с края цилиндра. 
| Дано: $\rho(H_2O) = 1 \, г/см^3$ $V(...) = ...$ $n(...) = ?$ $m = V\rho;$ $n = \frac{m}{M}$ $n(H_2O) =$ |
3. Измерьте длину ребра полого куба. Рассчитайте его объем. Представьте, что куб заполнен газом:
|
Оборудование
Оборудование: весы и разновесы, бюкс (или стаканчик на 25 см$^3$ (мл)), мерный цилиндр, полый куб, линейка, шпатели.
Вещества
Вещества: вода (в колбе), поваренная соль NaCl, питьевая сода NaHCO$_3$, кальцинированная сода Na$_2$CO$_3$, поташ K$_2$CO$_3$.
химическое количество вещества
| Вывод | |
Решение $M_r(NaCl) = $ $M(NaCl) = $ | Твердые вещества взвешивают Химическое количество поваренной соли NaCl в навеске массой _______ равно _______ |
Решение $M_r(H_2O) = $ $M(H_2O) = $ | Химическое количество воды H$_2$O в порции объемом _______ равно _______ |
Решение $V = a^3; n = \frac{V}{V_m}; V_m = 22,4 \, дм^3/моль$ |
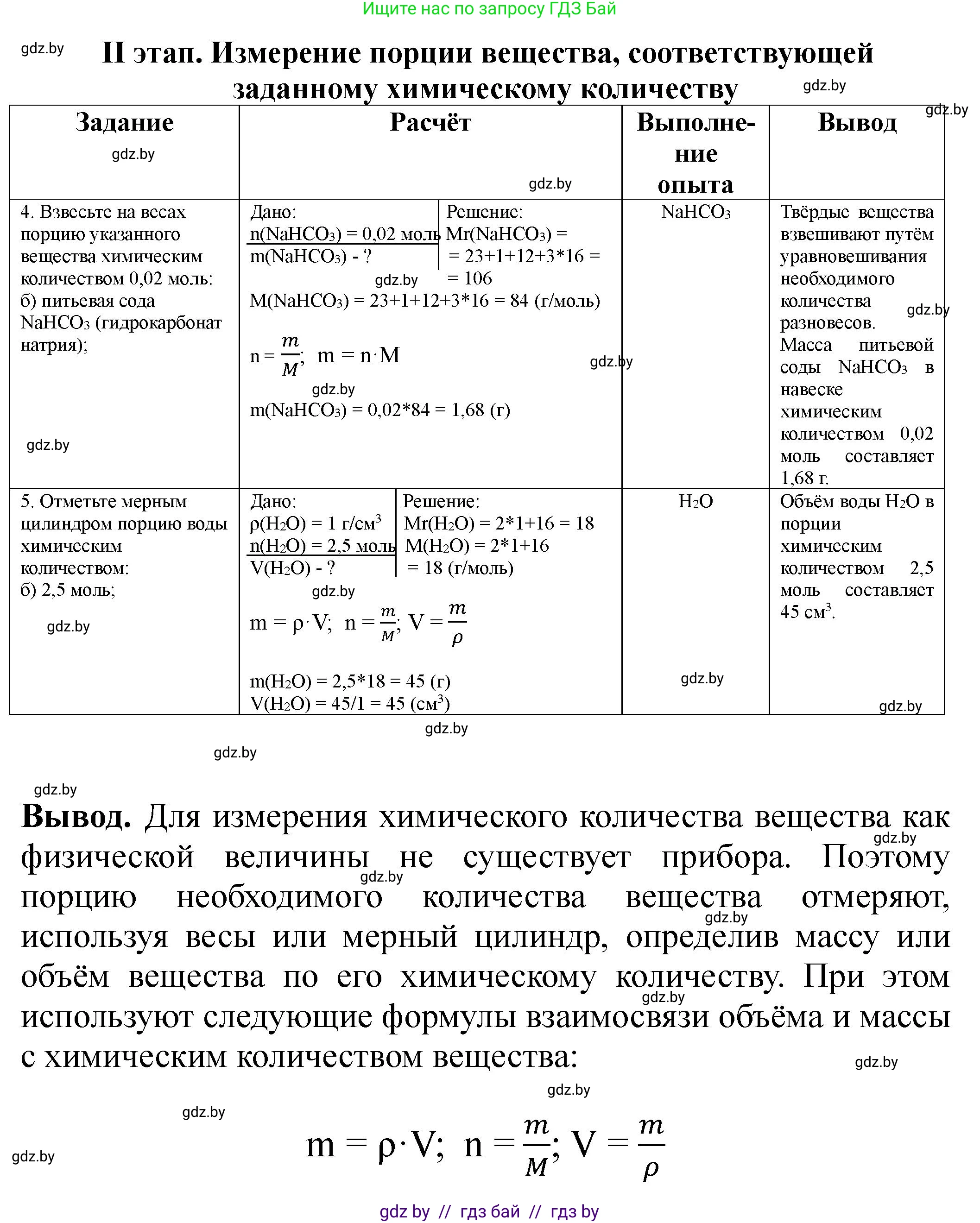
| Задание | Выполнение опыта | Расчет |
а) O$_2$; б) N$_2$; в) CO$_2$; г) NO$_2$. Рассчитайте химическое количество газообразного вещества в объеме данного куба. | Измерьте линейкой длину ребра выданного куба. Длина ребра: $a = $ 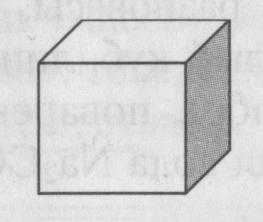
Формула газа _______ | Дано: $a = ...$ Найти: $n(...) = ?$ Решение |
II этап. Измерение порции вещества, соответствующей
| Задание | Расчет |
4. Взвесьте на весах порцию указанного вещества химическим количеством 0,02 моль: а) кальцинированная сода Na$_2$CO$_3$ (карбонат натрия); б) питьевая сода NaHCO$_3$ (гидрокарбонат натрия); в) поваренная соль NaCl (хлорид натрия); г) поташ K$_2$CO$_3$ (карбонат калия). | Дано:
Решение |
5. Отмерьте мерным цилиндром порцию воды химическим количеством: а) 1 моль; б) 2,5 моль; г) 5 моль. | Дано:
Решение |
Вывод. Для измерения химического количества вещества как физической величины не существует прибора. Поэтому порцию необходимого химического количества вещества отмеряют, используя весы или мерный цилиндр, определив массу или объем вещества по его химическому количеству. При этом используют следующие формулы взаимосвязи объема и массы с химическим количеством вещества:
| Вывод | |
заданному химическому количеству
| Выполнение опыта | Вывод | |

| ||
|
Решение. вариант 2 (с. 6)
Решение 2. вариант 2 (с. 6)
Взвесьте поваренную соль NaCl массой: а) 1,17 г; б) 2,34 г; в) 5,85 г; г) 4,68 г. Рассчитайте химическое количество вещества NaCl, соответствующее указанной порции.
Дано:
Массы NaCl:
а) $m(\text{NaCl}) = 1.17 \text{ г}$
б) $m(\text{NaCl}) = 2.34 \text{ г}$
в) $m(\text{NaCl}) = 5.85 \text{ г}$
г) $m(\text{NaCl}) = 4.68 \text{ г}$
Молярная масса NaCl: $M(\text{NaCl}) = 58.5 \text{ г/моль}$
Найти:
$n(\text{NaCl})$ для каждой массы
Решение:
Химическое количество вещества $n$ рассчитывается по формуле:
$n = \frac{m}{M}$
где $m$ - масса вещества, $M$ - молярная масса вещества.
Молярная масса NaCl рассчитывается как сумма атомных масс элементов, входящих в его состав:
$M(\text{NaCl}) = A_r(\text{Na}) + A_r(\text{Cl}) = 22.99 \text{ г/моль} + 35.45 \text{ г/моль} \approx 58.44 \text{ г/моль}$. Для практических расчетов округляем до $58.5 \text{ г/моль}$.
Выполняем расчеты для каждой порции:
а) Для $m(\text{NaCl}) = 1.17 \text{ г}$:
$n(\text{NaCl}) = \frac{1.17 \text{ г}}{58.5 \text{ г/моль}} = 0.02 \text{ моль}$
б) Для $m(\text{NaCl}) = 2.34 \text{ г}$:
$n(\text{NaCl}) = \frac{2.34 \text{ г}}{58.5 \text{ г/моль}} = 0.04 \text{ моль}$
в) Для $m(\text{NaCl}) = 5.85 \text{ г}$:
$n(\text{NaCl}) = \frac{5.85 \text{ г}}{58.5 \text{ г/моль}} = 0.1 \text{ моль}$
г) Для $m(\text{NaCl}) = 4.68 \text{ г}$:
$n(\text{NaCl}) = \frac{4.68 \text{ г}}{58.5 \text{ г/моль}} = 0.08 \text{ моль}$
Ответ:
а) $0.02 \text{ моль}$
б) $0.04 \text{ моль}$
в) $0.1 \text{ моль}$
г) $0.08 \text{ моль}$
2. Отмерьте мерным цилиндром воду объемом: а) 10 см$^{3}$; б) 27 см$^{3}$; в) 36 см$^{3}$; г) 80 см$^{3}$. Рассчитайте химическое количество вещества H$_{2}$O, соответствующее указанному объему (плотность воды равна 1 г/см$^{3}$).
Дано:
Плотность воды $\rho(\text{H}_2\text{O}) = 1 \text{ г/см}^3$
Объемы воды:
а) $V(\text{H}_2\text{O}) = 10 \text{ см}^3$
б) $V(\text{H}_2\text{O}) = 27 \text{ см}^3$
в) $V(\text{H}_2\text{O}) = 36 \text{ см}^3$
г) $V(\text{H}_2\text{O}) = 80 \text{ см}^3$
Молярная масса воды $M(\text{H}_2\text{O}) = 18 \text{ г/моль}$
Найти:
$n(\text{H}_2\text{O})$ для каждого объема
Решение:
Сначала найдем массу воды по формуле:
$m = \rho \cdot V$
Затем химическое количество $n$ по формуле:
$n = \frac{m}{M}$
Молярная масса воды:
$M(\text{H}_2\text{O}) = 2 \cdot A_r(\text{H}) + A_r(\text{O}) = 2 \cdot 1.008 \text{ г/моль} + 15.999 \text{ г/моль} \approx 18.015 \text{ г/моль}$. Для практических расчетов округляем до $18 \text{ г/моль}$.
Выполняем расчеты для каждого объема:
а) Для $V(\text{H}_2\text{O}) = 10 \text{ см}^3$:
$m(\text{H}_2\text{O}) = 1 \text{ г/см}^3 \cdot 10 \text{ см}^3 = 10 \text{ г}$
$n(\text{H}_2\text{O}) = \frac{10 \text{ г}}{18 \text{ г/моль}} \approx 0.556 \text{ моль}$
б) Для $V(\text{H}_2\text{O}) = 27 \text{ см}^3$:
$m(\text{H}_2\text{O}) = 1 \text{ г/см}^3 \cdot 27 \text{ см}^3 = 27 \text{ г}$
$n(\text{H}_2\text{O}) = \frac{27 \text{ г}}{18 \text{ г/моль}} = 1.5 \text{ моль}$
в) Для $V(\text{H}_2\text{O}) = 36 \text{ см}^3$:
$m(\text{H}_2\text{O}) = 1 \text{ г/см}^3 \cdot 36 \text{ см}^3 = 36 \text{ г}$
$n(\text{H}_2\text{O}) = \frac{36 \text{ г}}{18 \text{ г/моль}} = 2 \text{ моль}$
г) Для $V(\text{H}_2\text{O}) = 80 \text{ см}^3$:
$m(\text{H}_2\text{O}) = 1 \text{ г/см}^3 \cdot 80 \text{ см}^3 = 80 \text{ г}$
$n(\text{H}_2\text{O}) = \frac{80 \text{ г}}{18 \text{ г/моль}} \approx 4.444 \text{ моль}$
Ответ:
а) $0.556 \text{ моль}$
б) $1.5 \text{ моль}$
в) $2 \text{ моль}$
г) $4.444 \text{ моль}$
3. Измерьте длину ребра полого куба. Рассчитайте его объем. Представьте, что куб заполнен газом: а) O$_{2}$; б) N$_{2}$; в) CO$_{2}$; г) NO$_{2}$. Рассчитайте химическое количество газообразного вещества в объеме данного куба.
Дано:
Длина ребра куба $a = 10 \text{ см}$ (принято для примера, так как фактическое измерение невозможно)
Молярный объем газа при нормальных условиях $V_m = 22.4 \text{ дм}^3/\text{моль}$
Газы:
а) O$_2$
б) N$_2$
в) CO$_2$
г) NO$_2$
Перевод в СИ:
$a = 10 \text{ см} = 0.1 \text{ м}$
$V_m = 22.4 \text{ дм}^3/\text{моль} = 0.0224 \text{ м}^3/\text{моль}$
Найти:
Объем куба $V$
$n(\text{газа})$ для каждого газа
Решение:
Объем куба $V$ рассчитывается по формуле:
$V = a^3$
Химическое количество газа $n$ при нормальных условиях рассчитывается по формуле:
$n = \frac{V}{V_m}$
где $V$ - объем газа, $V_m$ - молярный объем газа ($22.4 \text{ дм}^3/\text{моль}$ при нормальных условиях).
Рассчитаем объем куба:
$V = (10 \text{ см})^3 = 1000 \text{ см}^3$
Поскольку $1 \text{ дм}^3 = 1000 \text{ см}^3$, то $V = 1 \text{ дм}^3$.
Теперь рассчитаем химическое количество каждого газа. При нормальных условиях молярный объем одинаков для всех газов, поэтому химическое количество будет одинаковым для всех перечисленных газов, занимающих один и тот же объем.
а) Для O$_2$:
$n(\text{O}_2) = \frac{1 \text{ дм}^3}{22.4 \text{ дм}^3/\text{моль}} \approx 0.0446 \text{ моль}$
б) Для N$_2$:
$n(\text{N}_2) = \frac{1 \text{ дм}^3}{22.4 \text{ дм}^3/\text{моль}} \approx 0.0446 \text{ моль}$
в) Для CO$_2$:
$n(\text{CO}_2) = \frac{1 \text{ дм}^3}{22.4 \text{ дм}^3/\text{моль}} \approx 0.0446 \text{ моль}$
г) Для NO$_2$:
$n(\text{NO}_2) = \frac{1 \text{ дм}^3}{22.4 \text{ дм}^3/\text{моль}} \approx 0.0446 \text{ моль}$
Ответ:
Объем куба: $1000 \text{ см}^3$ или $1 \text{ дм}^3$.
Химическое количество каждого газа (O$_2$, N$_2$, CO$_2$, NO$_2$): $0.0446 \text{ моль}$
4. Взвесьте на весах порцию указанного вещества химическим количеством 0,02 моль: а) кальцинированная сода Na$_{2}$CO$_{3}$ (карбонат натрия); б) питьевая сода NaHCO$_{3}$ (гидрокарбонат натрия); в) поваренная соль NaCl (хлорид натрия); г) поташ K$_{2}$CO$_{3}$ (карбонат калия).
Дано:
Химическое количество $n = 0.02 \text{ моль}$
Молярные массы веществ:
$M(\text{Na}_2\text{CO}_3) = 2 \cdot 23 + 12 + 3 \cdot 16 = 106 \text{ г/моль}$
$M(\text{NaHCO}_3) = 23 + 1 + 12 + 3 \cdot 16 = 84 \text{ г/моль}$
$M(\text{NaCl}) = 23 + 35.5 = 58.5 \text{ г/моль}$
$M(\text{K}_2\text{CO}_3) = 2 \cdot 39 + 12 + 3 \cdot 16 = 138 \text{ г/моль}$
Найти:
Масса $m$ для каждого вещества
Решение:
Масса вещества $m$ рассчитывается по формуле:
$m = n \cdot M$
где $n$ - химическое количество вещества, $M$ - молярная масса вещества.
Выполняем расчеты для каждого вещества:
а) Для Na$_2$CO$_3$:
$m(\text{Na}_2\text{CO}_3) = 0.02 \text{ моль} \cdot 106 \text{ г/моль} = 2.12 \text{ г}$
б) Для NaHCO$_3$:
$m(\text{NaHCO}_3) = 0.02 \text{ моль} \cdot 84 \text{ г/моль} = 1.68 \text{ г}$
в) Для NaCl:
$m(\text{NaCl}) = 0.02 \text{ моль} \cdot 58.5 \text{ г/моль} = 1.17 \text{ г}$
г) Для K$_2$CO$_3$:
$m(\text{K}_2\text{CO}_3) = 0.02 \text{ моль} \cdot 138 \text{ г/моль} = 2.76 \text{ г}$
Ответ:
а) $2.12 \text{ г}$
б) $1.68 \text{ г}$
в) $1.17 \text{ г}$
г) $2.76 \text{ г}$
5. Отмерьте мерным цилиндром порцию воды химическим количеством: а) 1 моль; б) 4 моль; в) 2,5 моль; г) 5 моль.
Дано:
Плотность воды $\rho(\text{H}_2\text{O}) = 1 \text{ г/см}^3$
Молярная масса воды $M(\text{H}_2\text{O}) = 18 \text{ г/моль}$
Химические количества воды:
а) $n(\text{H}_2\text{O}) = 1 \text{ моль}$
б) $n(\text{H}_2\text{O}) = 4 \text{ моль}$
в) $n(\text{H}_2\text{O}) = 2.5 \text{ моль}$
г) $n(\text{H}_2\text{O}) = 5 \text{ моль}$
Найти:
Объем $V(\text{H}_2\text{O})$ для каждого химического количества
Решение:
Сначала найдем массу воды по формуле:
$m = n \cdot M$
Затем объем воды $V$ по формуле:
$V = \frac{m}{\rho}$
Объединяя формулы, получаем:
$V = \frac{n \cdot M}{\rho}$
Выполняем расчеты для каждого химического количества:
а) Для $n(\text{H}_2\text{O}) = 1 \text{ моль}$:
$m(\text{H}_2\text{O}) = 1 \text{ моль} \cdot 18 \text{ г/моль} = 18 \text{ г}$
$V(\text{H}_2\text{O}) = \frac{18 \text{ г}}{1 \text{ г/см}^3} = 18 \text{ см}^3$
б) Для $n(\text{H}_2\text{O}) = 4 \text{ моль}$:
$m(\text{H}_2\text{O}) = 4 \text{ моль} \cdot 18 \text{ г/моль} = 72 \text{ г}$
$V(\text{H}_2\text{O}) = \frac{72 \text{ г}}{1 \text{ г/см}^3} = 72 \text{ см}^3$
в) Для $n(\text{H}_2\text{O}) = 2.5 \text{ моль}$:
$m(\text{H}_2\text{O}) = 2.5 \text{ моль} \cdot 18 \text{ г/моль} = 45 \text{ г}$
$V(\text{H}_2\text{O}) = \frac{45 \text{ г}}{1 \text{ г/см}^3} = 45 \text{ см}^3$
г) Для $n(\text{H}_2\text{O}) = 5 \text{ моль}$:
$m(\text{H}_2\text{O}) = 5 \text{ моль} \cdot 18 \text{ г/моль} = 90 \text{ г}$
$V(\text{H}_2\text{O}) = \frac{90 \text{ г}}{1 \text{ г/см}^3} = 90 \text{ см}^3$
Ответ:
а) $18 \text{ см}^3$
б) $72 \text{ см}^3$
в) $45 \text{ см}^3$
г) $90 \text{ см}^3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения вариант 2 расположенного на странице 6 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению вариант 2 (с. 6), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.














