вариант 1, страница 14, часть 1 - гдз по химии 8 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 1
Цвет обложки: розовый с пробирками
ISBN: 978-985-597-607-4
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Часть 1. Практические работы. Практическая работа 3 - страница 14.
вариант 1 (с. 14)
Условие. вариант 1 (с. 14)
скриншот условия



Практическая работа 3. « » ______ 20 г.
Решение экспериментальных задач
Цель: совершенствовать знания о химических свойствах и взаимопревращениях оксидов, кислот, оснований, солей.
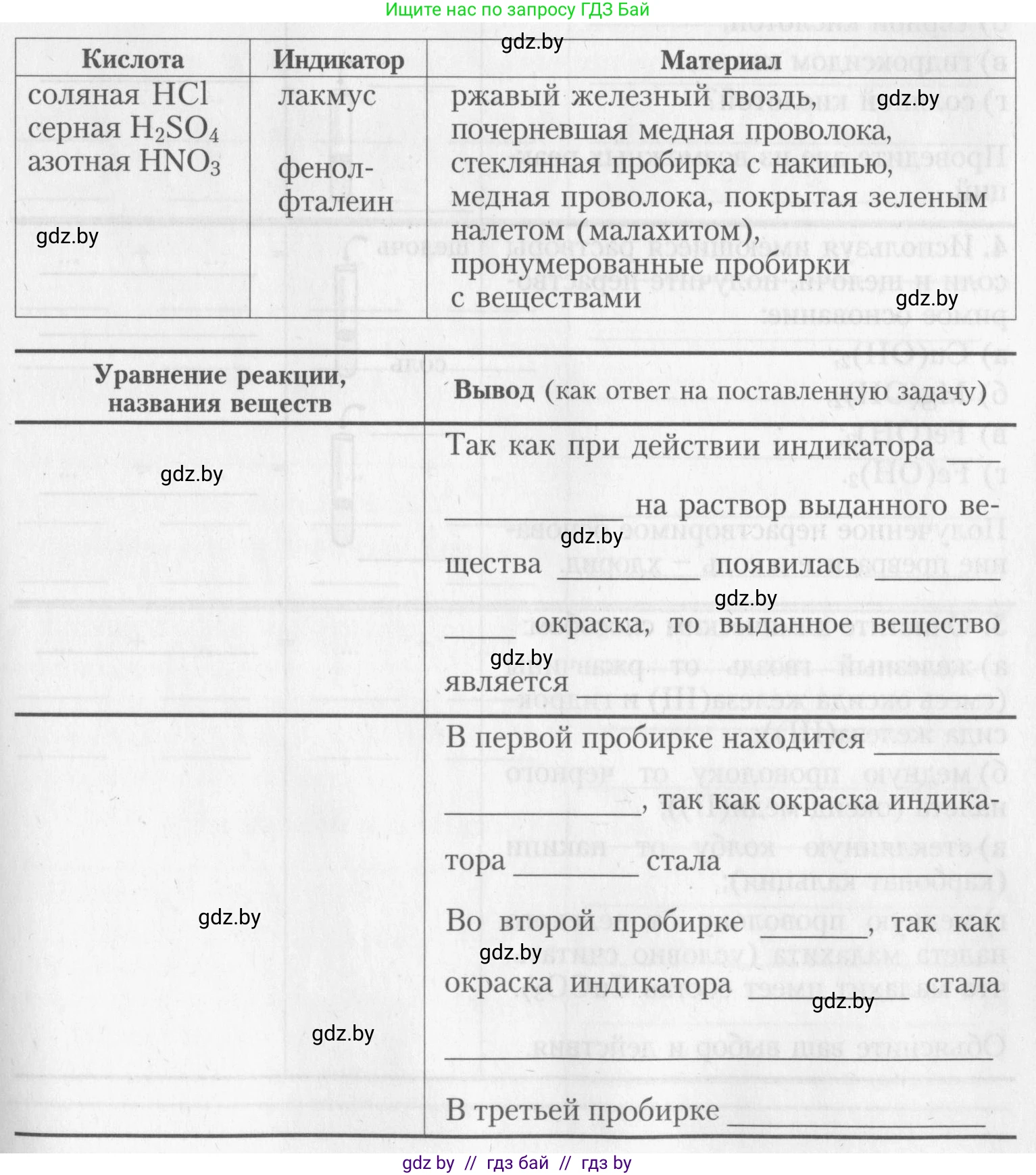
Оборудование и реактивы:
Металл Соль Щелочь
медь сульфат меди(II) $CuSO_4$ гидроксид натрия $NaOH$
$Cu$ сульфат магния $MgSO_4$ гидроксид калия $KOH$
цинк карбонат кальция $CaCO_3$ гидроксид кальция $Ca(OH)_2$
$Zn$ хлорид железа(III) $FeCl_3$
сульфат железа(II) $FeSO_4$
Вариант Задания
Задание Выполнение опыта Наблюдения
1. Используя индикатор, подтвердите, что выданное растворенное вещество:а) $HCl$ является кислотой;
б) $NaOH$ является щелочью;
в) $H_2SO_4$ является кислотой;
г) $Ca(OH)_2$ является щелочью.
индикатор
выданное вещество
___
___
2. Распознайте с помощью индикатора в трех выданных пронумерованных пробирках растворы:а) серной кислоты, гидроксида натрия и хлорида натрия;
б) гидроксида натрия, фосфорной кислоты, хлорида калия;
в) гидроксида кальция, хлорида кальция, хлороводородной кислоты;
г) серной кислоты, сульфата калия, гидроксида кальция.
Окраска в пробирках:
1 – ___
2 – ___
3 – ___
Кислота Индикатор Материал
соляная $HCl$ лакмус ржавый железный гвоздь,
серная $H_2SO_4$ фенол- почерневшая медная проволока,
азотная $HNO_3$ фталеин стеклянная пробирка с накипью,
медная проволока, покрытая зеленым налетом (малахитом),
пронумерованные пробирки с веществами
Уравнение реакции, названия веществ Вывод (как ответ на поставленную задачу)
Так как при действии индикатора ______ на раствор выданного вещества ______ появилась ______ окраска, то выданное вещество является ______.
В первой пробирке находится ______, так как окраска индикатора ______ стала ______.
Во второй пробирке ______, так как окраска индикатора ______ стала ______.
В третьей пробирке ______.
Задание Выполнение опыта Наблюдения
3. Имеются вещества $Zn$, $Cu$, $HNO_3$, $Ca(OH)_2$, $CaCO_3$, $FeSO_4$, $FeCl_3$. Какие из них будут реагировать с:а) гидроксидом натрия;
б) серной кислотой;
в) гидроксидом калия;
г) соляной кислотой?
Проведите две из возможных реакций.
___
___
4. Используя имеющиеся растворы соли и щелочи, получите нерастворимое основание:а) $Cu(OH)_2$;
б) $Mg(OH)_2$;
в) $Fe(OH)_3$;
г) $Fe(OH)_2$.
Полученное нерастворимое основание превратите в соль – хлорид.
щелочь
соль
___
___
5. Очистите химическим способом:а) железный гвоздь от ржавчины (смесь оксида железа(III) и гидроксида железа(III));
б) медную проволоку от черного налета (оксид меди(II));
в) стеклянную колбу от накипи (карбонат кальция);
г) медную проволоку от зеленого налета малахита (условно считать, что малахит имеет состав $CuCO_3$).
Объясните ваш выбор и действия.
___
___
Уравнение реакции, названия веществ Вывод (как ответ на поставленную задачу)
... + ... = ... + ...
_______ _______ _______ _______
... + ... = ... + ...
_______ _______ _______ _______
... + ... = ... + ...
_______ _______ _______ _______
... + ... = ... + ...
_______ _______ _______ _______
... + ... = ... + ...
_______ _______ _______ _______
Решение. вариант 1 (с. 14)

Решение 2. вариант 1 (с. 14)
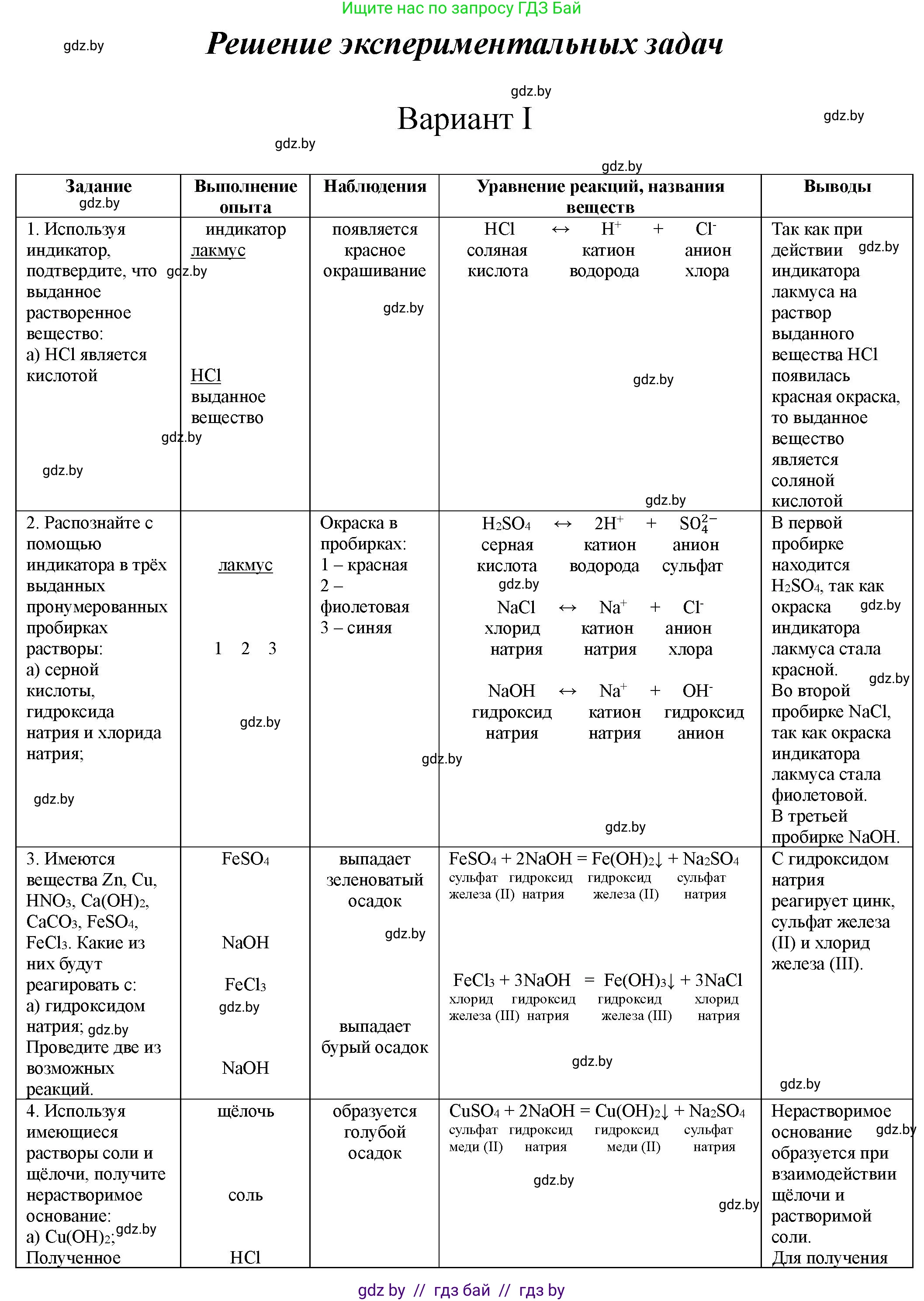
Используя индикатор, подтвердите, что выданное растворенное вещество:
a) HCl является кислотой;
Для подтверждения того, что HCl является кислотой, можно использовать лакмус или фенолфталеин. При добавлении лакмуса к раствору HCl, он окрасится в красный цвет. При добавлении фенолфталеина, раствор останется бесцветным.
Ответ: Лакмус - красный; фенолфталеин - бесцветный.
б) NaOH является щелочью;
Для подтверждения того, что NaOH является щелочью, можно использовать лакмус или фенолфталеин. При добавлении лакмуса к раствору NaOH, он окрасится в синий цвет. При добавлении фенолфталеина, раствор окрасится в малиновый цвет.
Ответ: Лакмус - синий; фенолфталеин - малиновый.
в) H2SO4 является кислотой;
Для подтверждения того, что H2SO4 является кислотой, можно использовать лакмус или фенолфталеин. При добавлении лакмуса к раствору H2SO4, он окрасится в красный цвет. При добавлении фенолфталеина, раствор останется бесцветным.
Ответ: Лакмус - красный; фенолфталеин - бесцветный.
г) Ca(OH)2 является щелочью.
Для подтверждения того, что Ca(OH)2 является щелочью, можно использовать лакмус или фенолфталеин. При добавлении лакмуса к раствору Ca(OH)2, он окрасится в синий цвет. При добавлении фенолфталеина, раствор окрасится в малиновый цвет.
Ответ: Лакмус - синий; фенолфталеин - малиновый.
2. Распознайте с помощью индикатора в трех выданных пронумерованных пробирках растворы:
Для распознавания веществ в пробирках используется лакмус как индикатор. Лакмус окрашивается в красный в кислой среде, в синий в щелочной среде и остается фиолетовым (или не меняет цвет) в нейтральной среде.
а) серной кислоты, гидроксида натрия и хлорида натрия;
Решение:
1. В каждую пробирку добавьте несколько капель лакмуса.
2. Пробирка, в которой лакмус станет красным, содержит серную кислоту (H2SO4).
3. Пробирка, в которой лакмус станет синим, содержит гидроксид натрия (NaOH).
4. Пробирка, в которой лакмус не изменит цвет (останется фиолетовым), содержит хлорид натрия (NaCl).
Ответ: H2SO4 (красный), NaOH (синий), NaCl (фиолетовый).
б) гидроксида натрия, фосфорной кислоты, хлорида калия;
Решение:
1. В каждую пробирку добавьте несколько капель лакмуса.
2. Пробирка, в которой лакмус станет синим, содержит гидроксид натрия (NaOH).
3. Пробирка, в которой лакмус станет красным, содержит фосфорную кислоту (H3PO4).
4. Пробирка, в которой лакмус не изменит цвет (останется фиолетовым), содержит хлорид калия (KCl).
Ответ: NaOH (синий), H3PO4 (красный), KCl (фиолетовый).
в) гидроксида кальция, хлорида кальция, хлороводородной кислоты;
Решение:
1. В каждую пробирку добавьте несколько капель лакмуса.
2. Пробирка, в которой лакмус станет синим, содержит гидроксид кальция (Ca(OH)2).
3. Пробирка, в которой лакмус станет красным, содержит хлороводородную кислоту (HCl).
4. Пробирка, в которой лакмус не изменит цвет (останется фиолетовым), содержит хлорид кальция (CaCl2).
Ответ: Ca(OH)2 (синий), HCl (красный), CaCl2 (фиолетовый).
г) серной кислоты, сульфата калия, гидроксида кальция.
Решение:
1. В каждую пробирку добавьте несколько капель лакмуса.
2. Пробирка, в которой лакмус станет красным, содержит серную кислоту (H2SO4).
3. Пробирка, в которой лакмус станет синим, содержит гидроксид кальция (Ca(OH)2).
4. Пробирка, в которой лакмус не изменит цвет (останется фиолетовым), содержит сульфат калия (K2SO4).
Ответ: H2SO4 (красный), Ca(OH)2 (синий), K2SO4 (фиолетовый).
3. Имеются вещества: Zn, Cu, HNO3, Ca(OH)2, CaCO3, FeSO4, FeCl3.
Какие из них будут реагировать с:
а) гидроксидом натрия;
Решение:
Гидроксид натрия (NaOH) будет реагировать с:
* Цинком (Zn), так как цинк является амфотерным металлом: $2NaOH + Zn + 2H_2O \rightarrow Na_2[Zn(OH)_4] + H_2 \uparrow$
* Азотной кислотой (HNO3), так как это реакция нейтрализации: $HNO_3 + NaOH \rightarrow NaNO_3 + H_2O$
* Сульфатом железа(II) (FeSO4), образуя нерастворимый гидроксид: $FeSO_4 + 2NaOH \rightarrow Fe(OH)_2 \downarrow + Na_2SO_4$
* Хлоридом железа(III) (FeCl3), образуя нерастворимый гидроксид: $FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
Не будет реагировать: Cu, Ca(OH)2, CaCO3.
Ответ: Zn, HNO3, FeSO4, FeCl3.
б) серной кислотой;
Решение:
Серная кислота (H2SO4) будет реагировать с:
* Цинком (Zn), так как цинк активный металл: $Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \uparrow$
* Гидроксидом кальция (Ca(OH)2), так как это реакция нейтрализации с образованием малорастворимого сульфата кальция: $Ca(OH)_2 + H_2SO_4 \rightarrow CaSO_4 \downarrow + 2H_2O$
* Карбонатом кальция (CaCO3), так как это реакция с образованием газа и малорастворимого сульфата кальция: $CaCO_3 + H_2SO_4 \rightarrow CaSO_4 \downarrow + H_2O + CO_2 \uparrow$
Не будет реагировать: Cu (с разбавленной), HNO3, FeSO4, FeCl3.
Ответ: Zn, Ca(OH)2, CaCO3.
в) гидроксидом калия;
Решение:
Гидроксид калия (KOH) будет реагировать с:
* Цинком (Zn): $2KOH + Zn + 2H_2O \rightarrow K_2[Zn(OH)_4] + H_2 \uparrow$
* Азотной кислотой (HNO3): $HNO_3 + KOH \rightarrow KNO_3 + H_2O$
* Сульфатом железа(II) (FeSO4): $FeSO_4 + 2KOH \rightarrow Fe(OH)_2 \downarrow + K_2SO_4$
* Хлоридом железа(III) (FeCl3): $FeCl_3 + 3KOH \rightarrow Fe(OH)_3 \downarrow + 3KCl$
Не будет реагировать: Cu, Ca(OH)2, CaCO3.
Ответ: Zn, HNO3, FeSO4, FeCl3.
г) соляной кислотой?
Решение:
Соляная кислота (HCl) будет реагировать с:
* Цинком (Zn): $Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
* Гидроксидом кальция (Ca(OH)2): $Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O$
* Карбонатом кальция (CaCO3): $CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
Не будет реагировать: Cu, HNO3, FeSO4, FeCl3.
Ответ: Zn, Ca(OH)2, CaCO3.
Проведите две из возможных реакций.
Решение:
Выберем следующие реакции:
1. Взаимодействие цинка с серной кислотой:
$Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \uparrow$
Наблюдения: При добавлении серной кислоты к цинку наблюдается выделение пузырьков газа (водорода).
2. Взаимодействие хлорида железа(III) с гидроксидом натрия:
$FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
Наблюдения: При добавлении раствора гидроксида натрия к раствору хлорида железа(III) образуется бурый осадок гидроксида железа(III).
Ответ: См. выше.
4. Используя имеющиеся растворы соли и щелочи, получите нерастворимое основание:
Для получения нерастворимого основания необходимо провести реакцию обмена между растворимой солью соответствующего металла и растворимой щелочью. Затем полученное нерастворимое основание обработать соляной кислотой для получения хлорида.
а) Cu(OH)2;
Решение:
1. Получение Cu(OH)2: Смешать растворы сульфата меди(II) (CuSO4) и гидроксида натрия (NaOH).
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$
Наблюдения: Образуется синий желеобразный осадок.
2. Превращение Cu(OH)2 в хлорид: Добавить соляную кислоту (HCl) к осадку Cu(OH)2.
$Cu(OH)_2 + 2HCl \rightarrow CuCl_2 + 2H_2O$
Наблюдения: Синий осадок растворяется, образуя синий раствор хлорида меди(II).
Ответ: См. выше.
б) Mg(OH)2;
Решение:
1. Получение Mg(OH)2: Смешать растворы сульфата магния (MgSO4) и гидроксида натрия (NaOH).
$MgSO_4 + 2NaOH \rightarrow Mg(OH)_2 \downarrow + Na_2SO_4$
Наблюдения: Образуется белый желеобразный осадок.
2. Превращение Mg(OH)2 в хлорид: Добавить соляную кислоту (HCl) к осадку Mg(OH)2.
$Mg(OH)_2 + 2HCl \rightarrow MgCl_2 + 2H_2O$
Наблюдения: Белый осадок растворяется, образуя бесцветный раствор хлорида магния.
Ответ: См. выше.
в) Fe(OH)3;
Решение:
1. Получение Fe(OH)3: Смешать растворы хлорида железа(III) (FeCl3) и гидроксида натрия (NaOH).
$FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
Наблюдения: Образуется бурый желеобразный осадок.
2. Превращение Fe(OH)3 в хлорид: Добавить соляную кислоту (HCl) к осадку Fe(OH)3.
$Fe(OH)_3 + 3HCl \rightarrow FeCl_3 + 3H_2O$
Наблюдения: Бурый осадок растворяется, образуя желтоватый/коричневатый раствор хлорида железа(III).
Ответ: См. выше.
г) Fe(OH)2.
Решение:
1. Получение Fe(OH)2: Смешать растворы сульфата железа(II) (FeSO4) и гидроксида натрия (NaOH). (Важно исключить контакт с воздухом, так как Fe(OH)2 легко окисляется до Fe(OH)3).
$FeSO_4 + 2NaOH \rightarrow Fe(OH)_2 \downarrow + Na_2SO_4$
Наблюдения: Образуется белый, быстро зеленеющий, а затем буреющий на воздухе осадок.
2. Превращение Fe(OH)2 в хлорид: Добавить соляную кислоту (HCl) к осадку Fe(OH)2.
$Fe(OH)_2 + 2HCl \rightarrow FeCl_2 + 2H_2O$
Наблюдения: Белый осадок растворяется, образуя бледно-зеленый раствор хлорида железа(II).
Ответ: См. выше.
5. Очистите химическим способом:
а) железный гвоздь от ржавчины (смесь оксида железа(III) и гидрок-сида железа(III));
Решение:
Выбор: Для удаления ржавчины (оксидов и гидроксидов железа) используют сильные кислоты, такие как соляная (HCl) или серная (H2SO4). Соляная кислота предпочтительнее для быстрого очищения.
Действие: Поместить железный гвоздь в раствор соляной кислоты.
Объяснение: Кислота реагирует с оксидом и гидроксидом железа, образуя растворимые соли и воду, таким образом удаляя ржавчину с поверхности металла.
Уравнение реакции:
$Fe_2O_3 + 6HCl \rightarrow 2FeCl_3 + 3H_2O$
$Fe(OH)_3 + 3HCl \rightarrow FeCl_3 + 3H_2O$
Наблюдения: Ржавчина постепенно растворяется, раствор окрашивается в желто-коричневый цвет (из-за FeCl3). Может наблюдаться выделение небольших пузырьков водорода, если кислота достаточно концентрирована и воздействует на само железо, но основная реакция - с ржавчиной.
Ответ: Использовать раствор соляной кислоты.
б) медную проволоку от черного налета (оксид меди(II));
Решение:
Выбор: Черный налет на медной проволоке - это оксид меди(II) (CuO), который является основным оксидом. Для его удаления используют кислоты, например, соляную (HCl) или серную (H2SO4).
Действие: Поместить медную проволоку с черным налетом в раствор соляной кислоты.
Объяснение: Кислота реагирует с оксидом меди(II), образуя растворимую соль и воду, что приводит к исчезновению черного налета.
Уравнение реакции:
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Наблюдения: Черный налет постепенно исчезает, раствор окрашивается в сине-зеленый цвет (из-за CuCl2).
Ответ: Использовать раствор соляной кислоты.
в) стеклянную колбу от накипи (карбонат кальция);
Решение:
Выбор: Накипь в стеклянной колбе - это карбонат кальция (CaCO3). Для его удаления используют кислоты, которые реагируют с карбонатами с выделением углекислого газа. Подойдут соляная (HCl) или уксусная кислота (CH3COOH).
Действие: Залить в колбу раствор соляной кислоты (или уксусной кислоты).
Объяснение: Кислота реагирует с карбонатом кальция, растворяя его и образуя газ (CO2), воду и растворимую соль.
Уравнение реакции:
$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
Наблюдения: Наблюдается шипение и выделение пузырьков газа (углекислого газа), накипь постепенно растворяется.
Ответ: Использовать раствор соляной кислоты (или уксусной кислоты).
г) медную проволоку от зеленого налета малахита (условно считать, что малахит имеет состав CuCO3).
Решение:
Выбор: Зеленый налет малахита (CuCO3) на медной проволоке является основным карбонатом. Для его удаления используют кислоты, так как карбонаты реагируют с кислотами. Подойдет соляная (HCl) или серная (H2SO4) кислота.
Действие: Поместить медную проволоку с зеленым налетом в раствор соляной кислоты.
Объяснение: Кислота реагирует с карбонатом меди(II), растворяя его и образуя газ (CO2), воду и растворимую соль.
Уравнение реакции:
$CuCO_3 + 2HCl \rightarrow CuCl_2 + H_2O + CO_2 \uparrow$
Наблюдения: Зеленый налет постепенно растворяется, наблюдается выделение пузырьков газа (углекислого газа), раствор окрашивается в сине-зеленый цвет.
Ответ: Использовать раствор соляной кислоты.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения вариант 1 расположенного на странице 14 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению вариант 1 (с. 14), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.














