Номер 133, страница 35 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 9. Ионы в растворах электролитов - номер 133, страница 35.
№133 (с. 35)
Условие. №133 (с. 35)
скриншот условия

133. Радиус какой частицы больше:
а) F или $F^-$;
б) Be или $Be^{2+}$;
в) $Li^+$ или $Na^+$;
г) Li или $Li^+$;
д) S или $S^{2-}$;
е) $Na^+$ или $Mg^{2+}$;
ё) Al или $Al^{3+}$;
ж) $Cl^-$ или $Br^-$;
з) $Na^+$ или $Cl^-$?
Решение. №133 (с. 35)
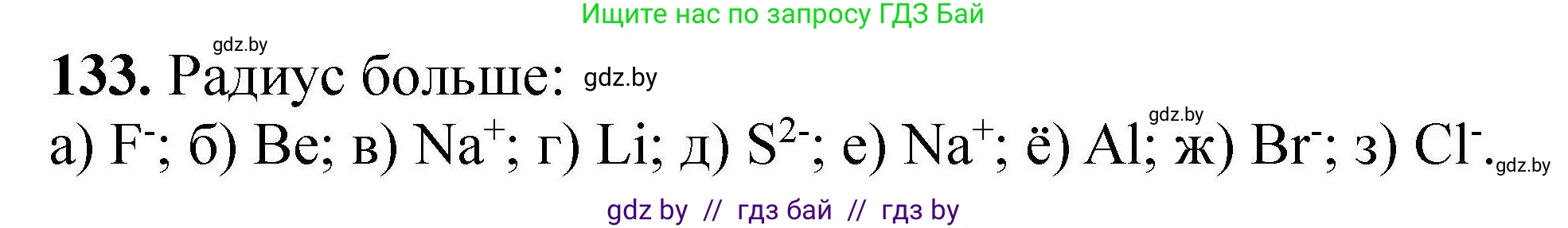
Решение 2. №133 (с. 35)
а) F или F⁻
Атом фтора (F) имеет 9 протонов и 9 электронов. Ион фторида (F⁻) образуется, когда атом фтора принимает один дополнительный электрон. В результате F⁻ имеет 9 протонов и 10 электронов. При одинаковом заряде ядра (+9) возросшее число электронов приводит к усилению межэлектронного отталкивания, что вызывает расширение электронной оболочки. Поэтому радиус аниона больше радиуса соответствующего нейтрального атома.
Ответ:F⁻.
б) Be или Be²⁺
Атом бериллия (Be) имеет 4 протона и 4 электрона ($1s^22s^2$). Катион бериллия (Be²⁺) образуется при потере двух электронов. В результате у Be²⁺ остается 4 протона и 2 электрона ($1s^2$), а также теряется целый внешний электронный слой (второй). Уменьшение числа электронов и потеря внешнего слоя при неизменном заряде ядра приводят к тому, что оставшиеся электроны притягиваются к ядру значительно сильнее. Поэтому радиус катиона всегда меньше радиуса соответствующего нейтрального атома.
Ответ:Be.
в) Li⁺ или Na⁺
Ионы лития (Li⁺) и натрия (Na⁺) являются катионами щелочных металлов, расположенных в одной группе, но в разных периодах (Li во втором, Na в третьем). Ион Na⁺ имеет электронную конфигурацию $1s^22s^22p^6$ (заполненный второй электронный слой), а ион Li⁺ - $1s^2$ (заполненный первый электронный слой). Так как у иона натрия больше электронных слоев, его радиус больше, чем у иона лития. Вдоль группы радиусы атомов и ионов увеличиваются.
Ответ:Na⁺.
г) Li или Li⁺
Атом лития (Li) имеет 3 протона и 3 электрона ($1s^22s^1$). Катион лития (Li⁺) образуется при потере одного электрона с внешнего слоя. В результате у Li⁺ остается 3 протона и 2 электрона ($1s^2$). Потеря внешнего электрона приводит к уменьшению радиуса, так как оставшиеся электроны сильнее притягиваются к ядру, а также исчезает внешний электронный слой.
Ответ:Li.
д) S или S²⁻
Атом серы (S) имеет 16 протонов и 16 электронов. Ион сульфида (S²⁻) образуется при присоединении двух электронов. В результате у S²⁻ 16 протонов и 18 электронов. Дополнительные электроны увеличивают межэлектронное отталкивание в электронной оболочке, что приводит к ее расширению. Заряд ядра при этом не меняется. Следовательно, радиус аниона S²⁻ больше, чем у нейтрального атома S.
Ответ:S²⁻.
e) Na⁺ или Mg²⁺
Ионы Na⁺ и Mg²⁺ являются изоэлектронными, то есть имеют одинаковое количество электронов (10) и одинаковую электронную конфигурацию ($1s^22s^22p^6$). Однако они имеют разный заряд ядра: у натрия +11, а у магния +12. Чем больше заряд ядра, тем сильнее оно притягивает электроны. Так как ядро магния имеет больший заряд, оно стягивает электронную оболочку сильнее, чем ядро натрия. Поэтому радиус иона Mg²⁺ меньше, чем у Na⁺.
Ответ:Na⁺.
ё) Al или Al³⁺
Атом алюминия (Al) имеет 13 протонов и 13 электронов ($[Ne]3s^23p^1$). Катион алюминия (Al³⁺) образуется при потере трех внешних электронов. В результате у Al³⁺ остается 13 протонов и 10 электронов ($[Ne]$), а также теряется целый третий электронный слой. Как и в других случаях образования катионов, это приводит к значительному уменьшению радиуса частицы.
Ответ:Al.
ж) Cl⁻ или Br⁻
Ионы хлорида (Cl⁻) и бромида (Br⁻) являются анионами галогенов, расположенных в одной группе. Хлор находится в третьем периоде, а бром — в четвертом. Внешние электроны иона Cl⁻ находятся на третьем энергетическом уровне, а у иона Br⁻ — на четвертом. Наличие дополнительного электронного слоя у Br⁻ делает его радиус больше, чем у Cl⁻.
Ответ:Br⁻.
з) Na⁺ или Cl⁻
Ион натрия (Na⁺) образуется из атома натрия (3-й период) путем потери одного электрона, в результате чего его внешним становится второй электронный слой ($1s^22s^22p^6$). Ион хлорида (Cl⁻) образуется из атома хлора (также 3-й период) путем приобретения одного электрона, при этом его третий электронный слой становится завершенным ($[Ne]3s^23p^6$). Так как у иона Cl⁻ электроны находятся на третьем энергетическом уровне, а у иона Na⁺ — на втором, радиус Cl⁻ значительно больше радиуса Na⁺.
Ответ:Cl⁻.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 133 расположенного на странице 35 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №133 (с. 35), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














