Номер 134, страница 35 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 9. Ионы в растворах электролитов - номер 134, страница 35.
№134 (с. 35)
Условие. №134 (с. 35)
скриншот условия

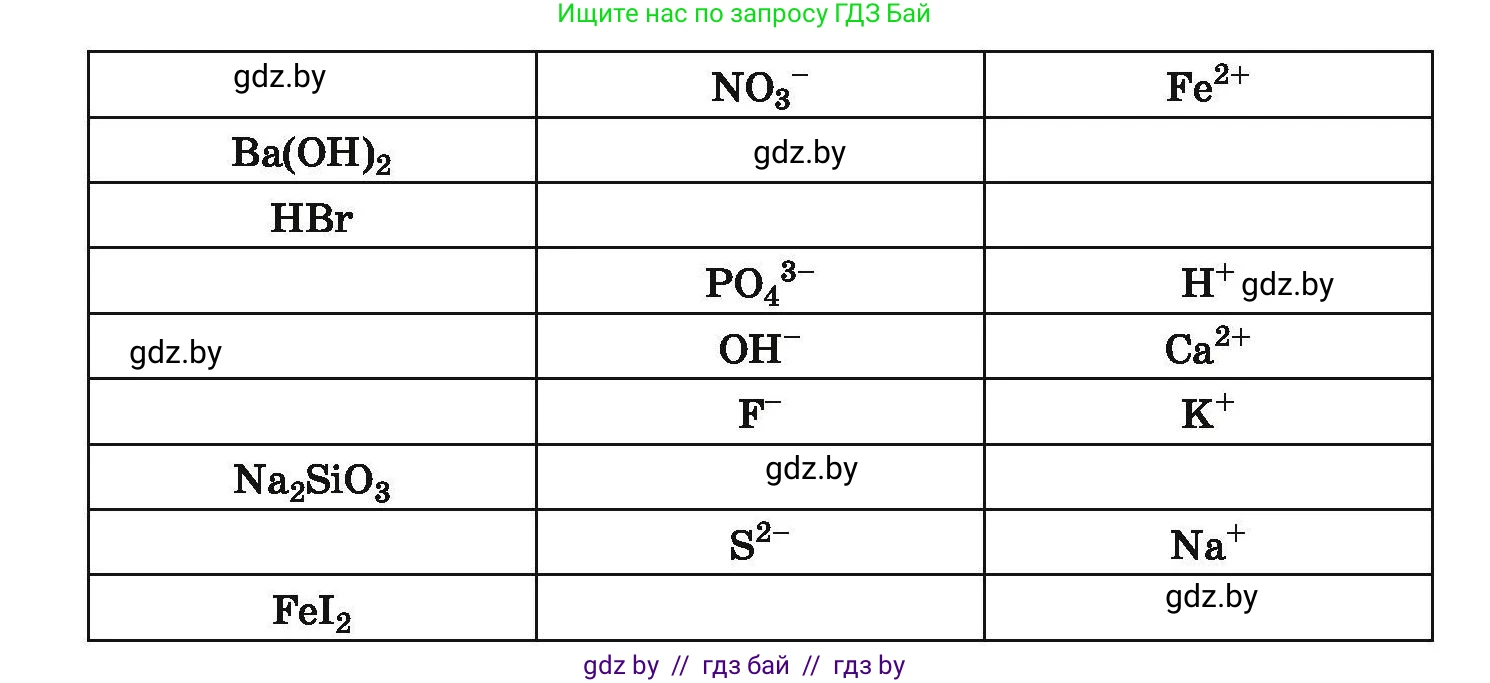
134. Начертите в тетради таблицу и заполните её, взяв за образец первую строчку:
ЭлектролитАнионКатион
$CuSO_4$ $SO_4^{2-}$ $Cu^{2+}$
$AlCl_3$
$Cl^-$ $NH_4^+$
$Na_2SO_3$
$NO_3^-$ $Fe^{2+}$
$Ba(OH)_2$
$HBr$
$PO_4^{3-}$ $H^+$
$OH^-$ $Ca^{2+}$
$F^-$ $K^+$
$Na_2SiO_3$
$S^{2-}$ $Na^+$
$FeI_2$
Решение. №134 (с. 35)
Решение 2. №134 (с. 35)
Электролит AlCl3
Решение: Хлорид алюминия ($AlCl_3$) — это соль, которая при растворении в воде диссоциирует на ионы. Алюминий ($Al$) — металл 13-й группы периодической системы, в соединениях обычно проявляет степень окисления +3, образуя катион $Al^{3+}$. Хлор ($Cl$) — галоген, находится в 17-й группе и образует анион с зарядом -1, то есть хлорид-ион $Cl^{-}$. Уравнение диссоциации хлорида алюминия: $AlCl_3 \leftrightarrows Al^{3+} + 3Cl^{-}$. Следовательно, катионом является $Al^{3+}$, а анионом — $Cl^{-}$.
Ответ: Анион: $Cl^{-}$, Катион: $Al^{3+}$.
Анион Cl- и Катион NH4+
Решение: Необходимо составить формулу электролита, зная его составные ионы: катион аммония $NH_4^{+}$ с зарядом +1 и хлорид-анион $Cl^{-}$ с зарядом -1. Для того чтобы молекула была электронейтральной, суммарный положительный заряд всех катионов должен быть равен по модулю суммарному отрицательному заряду всех анионов. В данном случае заряды ионов равны по величине (1) и противоположны по знаку, поэтому для образования нейтральной молекулы соли требуется один катион $NH_4^{+}$ и один анион $Cl^{-}$. Таким образом, формула электролита — $NH_4Cl$ (хлорид аммония).
Ответ: Электролит: $NH_4Cl$.
Электролит Na2SO3
Решение: Сульфит натрия ($Na_2SO_3$) — это соль, которая диссоциирует в водном растворе. Натрий ($Na$) — щелочной металл (1-я группа), всегда образует катион с зарядом +1 ($Na^{+}$). Кислотный остаток сернистой кислоты ($H_2SO_3$) — это сульфит-ион. Так как в формуле соли два иона натрия, их суммарный заряд +2. Для сохранения электронейтральности молекулы сульфит-ион должен иметь заряд -2, то есть $SO_3^{2-}$. Уравнение диссоциации: $Na_2SO_3 \leftrightarrows 2Na^{+} + SO_3^{2-}$.
Ответ: Анион: $SO_3^{2-}$, Катион: $Na^{+}$.
Анион NO3- и Катион Fe2+
Решение: Для составления формулы электролита комбинируем катион железа(II) ($Fe^{2+}$) с зарядом +2 и нитрат-анион ($NO_3^{-}$) с зарядом -1. Для соблюдения принципа электронейтральности суммарный заряд должен быть равен нулю. На один двухзарядный катион $Fe^{2+}$ должно приходиться два однозарядных аниона $NO_3^{-}$, чтобы скомпенсировать положительный заряд ($+2 + 2 \times (-1) = 0$). Формула вещества — $Fe(NO_3)_2$ (нитрат железа(II)).
Ответ: Электролит: $Fe(NO_3)_2$.
Электролит Ba(OH)2
Решение: Гидроксид бария ($Ba(OH)_2$) — это сильное основание (щёлочь), которое хорошо диссоциирует в воде. Барий ($Ba$) — щелочноземельный металл (2-я группа), образует двухзарядный катион $Ba^{2+}$. Гидроксильная группа ($OH$) имеет заряд -1 и является анионом ($OH^{-}$). Уравнение диссоциации: $Ba(OH)_2 \leftrightarrows Ba^{2+} + 2OH^{-}$.
Ответ: Анион: $OH^{-}$, Катион: $Ba^{2+}$.
Электролит HBr
Решение: Бромоводородная кислота ($HBr$) — сильная кислота, которая в водном растворе практически полностью диссоциирует. При диссоциации кислот образуется катион водорода ($H^{+}$) и анион кислотного остатка. В данном случае анионом является бромид-ион ($Br^{-}$). Уравнение диссоциации: $HBr \rightarrow H^{+} + Br^{-}$.
Ответ: Анион: $Br^{-}$, Катион: $H^{+}$.
Анион PO43- и Катион H+
Решение: Составляем формулу электролита из катиона водорода ($H^{+}$) с зарядом +1 и фосфат-аниона ($PO_4^{3-}$) с зарядом -3. Для электронейтральности молекулы на один трехзарядный анион $PO_4^{3-}$ необходимо три однозарядных катиона $H^{+}$. Полученное соединение — ортофосфорная кислота (или просто фосфорная кислота) с формулой $H_3PO_4$.
Ответ: Электролит: $H_3PO_4$.
Анион OH- и Катион Ca2+
Решение: Составляем формулу основания из катиона кальция ($Ca^{2+}$) с зарядом +2 и гидроксид-аниона ($OH^{-}$) с зарядом -1. Для компенсации заряда катиона кальция необходимо два гидроксид-аниона ($+2 + 2 \times (-1) = 0$). Таким образом, формула электролита — $Ca(OH)_2$ (гидроксид кальция).
Ответ: Электролит: $Ca(OH)_2$.
Анион F- и Катион K+
Решение: Составляем формулу соли из катиона калия ($K^{+}$) с зарядом +1 и фторид-аниона ($F^{-}$) с зарядом -1. Так как заряды ионов равны по модулю и противоположны по знаку, для образования электронейтральной молекулы необходимо по одному иону каждого вида. Формула вещества — $KF$ (фторид калия).
Ответ: Электролит: $KF$.
Электролит Na2SiO3
Решение: Силикат натрия ($Na_2SiO_3$) — это соль, диссоциирующая в воде. Катион натрия ($Na^{+}$) имеет заряд +1. Так как в формуле указано два иона натрия, их суммарный положительный заряд равен +2. Следовательно, анион кремниевой кислоты — силикат-ион ($SiO_3$) — должен иметь заряд -2 для обеспечения электронейтральности молекулы. Формула аниона — $SiO_3^{2-}$. Уравнение диссоциации: $Na_2SiO_3 \leftrightarrows 2Na^{+} + SiO_3^{2-}$.
Ответ: Анион: $SiO_3^{2-}$, Катион: $Na^{+}$.
Анион S2- и Катион Na+
Решение: Составляем формулу соли из катиона натрия ($Na^{+}$) с зарядом +1 и сульфид-аниона ($S^{2-}$) с зарядом -2. Для того чтобы молекула была электронейтральной, на один двухзарядный сульфид-анион требуется два однозарядных катиона натрия. Формула электролита — $Na_2S$ (сульфид натрия).
Ответ: Электролит: $Na_2S$.
Электролит FeI2
Решение: Иодид железа(II) ($FeI_2$) — это соль, которая диссоциирует в воде. Йод ($I$) — галоген, образует иодид-анион с зарядом -1 ($I^{-}$). В формуле присутствуют два иодид-аниона, их суммарный отрицательный заряд равен -2. Следовательно, для электронейтральности молекулы катион железа должен иметь заряд +2. Формула катиона — $Fe^{2+}$. Уравнение диссоциации: $FeI_2 \leftrightarrows Fe^{2+} + 2I^{-}$.
Ответ: Анион: $I^{-}$, Катион: $Fe^{2+}$.
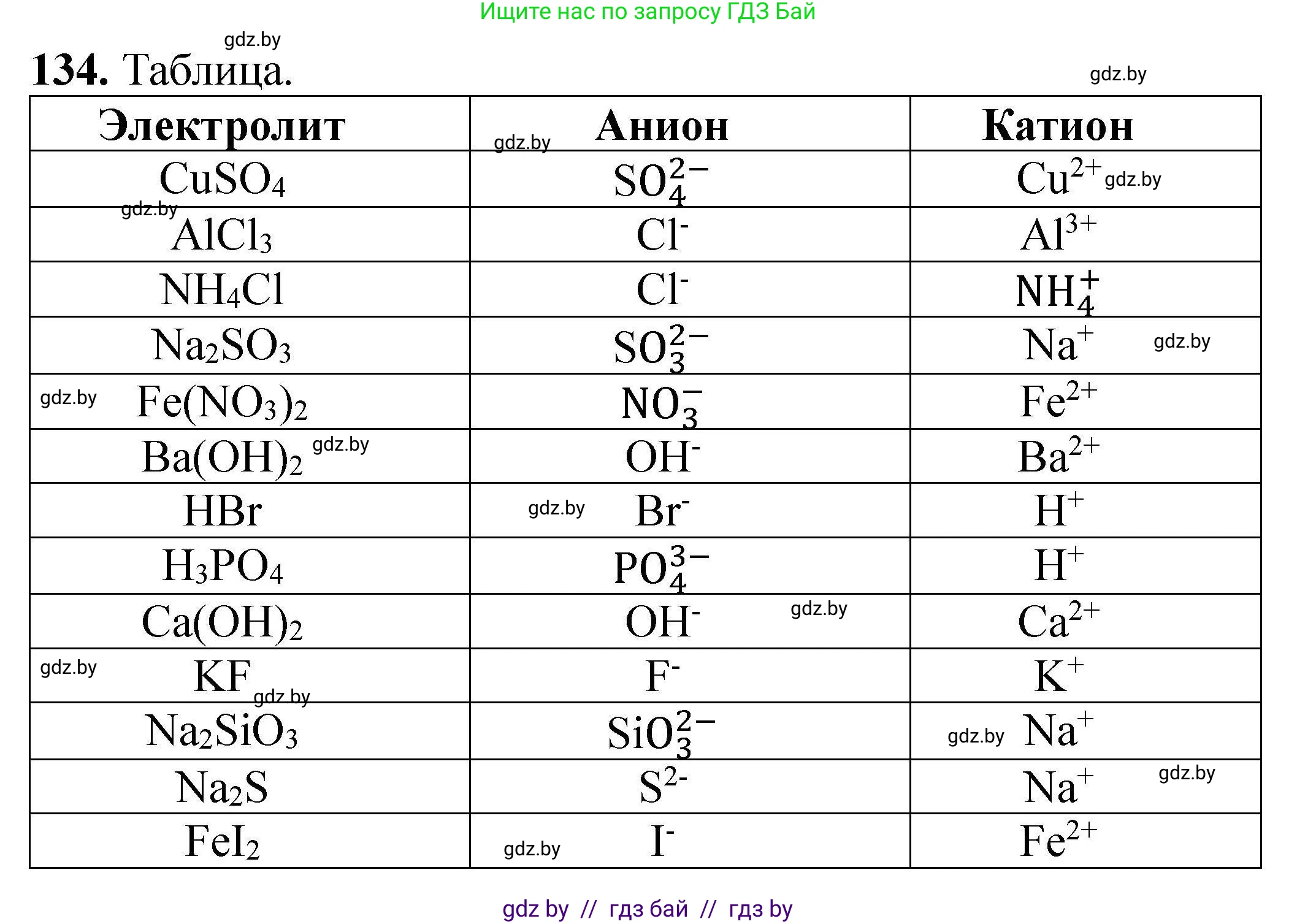
Итоговая заполненная таблица:
| Электролит | Анион | Катион |
|---|---|---|
| $CuSO_4$ | $SO_4^{2-}$ | $Cu^{2+}$ |
| $AlCl_3$ | $Cl^{-}$ | $Al^{3+}$ |
| $NH_4Cl$ | $Cl^{-}$ | $NH_4^{+}$ |
| $Na_2SO_3$ | $SO_3^{2-}$ | $Na^{+}$ |
| $Fe(NO_3)_2$ | $NO_3^{-}$ | $Fe^{2+}$ |
| $Ba(OH)_2$ | $OH^{-}$ | $Ba^{2+}$ |
| $HBr$ | $Br^{-}$ | $H^{+}$ |
| $H_3PO_4$ | $PO_4^{3-}$ | $H^{+}$ |
| $Ca(OH)_2$ | $OH^{-}$ | $Ca^{2+}$ |
| $KF$ | $F^{-}$ | $K^{+}$ |
| $Na_2SiO_3$ | $SiO_3^{2-}$ | $Na^{+}$ |
| $Na_2S$ | $S^{2-}$ | $Na^{+}$ |
| $FeI_2$ | $I^{-}$ | $Fe^{2+}$ |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 134 расположенного на странице 35 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №134 (с. 35), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














