Номер 374, страница 76 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 22. Сульфаты — соли серной кислоты. Применение серной кислоты и сульфатов - номер 374, страница 76.
№374 (с. 76)
Условие. №374 (с. 76)
скриншот условия

374. Массовая доля кислорода в составе сульфата двухвалентного металла равна 53,33 %. Установите металл и рассчитайте его массовую долю в этом сульфате.
Решение. №374 (с. 76)

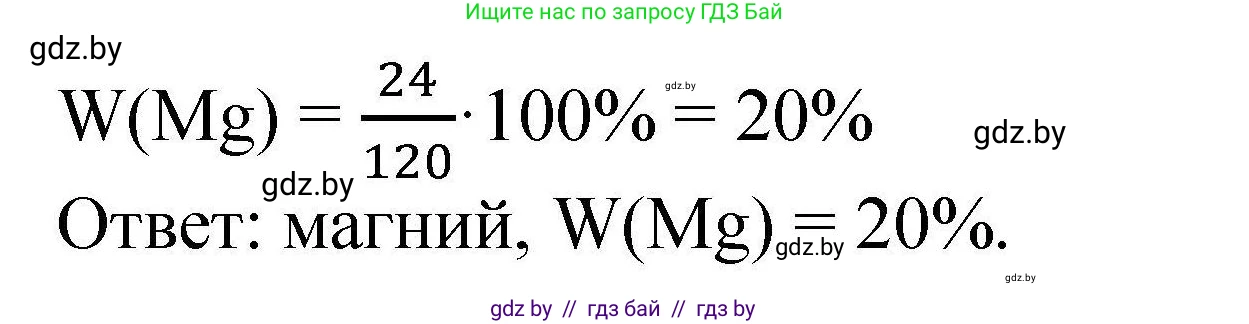
Решение 2. №374 (с. 76)
Дано:
Массовая доля кислорода в сульфате двухвалентного металла $w(O) = 53,33 \% = 0,5333$
Найти:
1. Неизвестный металл (Me)
2. Массовую долю металла в этом сульфате $w(Me)$
Решение:
1. Установление металла.
Так как металл является двухвалентным, а сульфат-ион $SO_4^{2-}$ также имеет заряд -2, общая формула сульфата будет $MeSO_4$, где $Me$ – неизвестный металл.
Массовая доля элемента в соединении рассчитывается по формуле:
$w(Э) = \frac{n \cdot Ar(Э)}{Mr(соединения)}$
где $n$ — число атомов элемента в формульной единице, $Ar(Э)$ — относительная атомная масса элемента, $Mr(соединения)$ — относительная молекулярная (формульная) масса соединения.
Выразим относительную молекулярную массу сульфата $MeSO_4$:
$Mr(MeSO_4) = Ar(Me) + Ar(S) + 4 \cdot Ar(O)$
Используя относительные атомные массы серы ($Ar(S) \approx 32$) и кислорода ($Ar(O) \approx 16$), получаем:
$Mr(MeSO_4) = Ar(Me) + 32 + 4 \cdot 16 = Ar(Me) + 96$
Массовая доля кислорода в $MeSO_4$ составляет:
$w(O) = \frac{4 \cdot Ar(O)}{Mr(MeSO_4)} = \frac{4 \cdot 16}{Ar(Me) + 96} = \frac{64}{Ar(Me) + 96}$
По условию задачи, $w(O) = 53,33\%$, или 0,5333 в долях от единицы. Подставим это значение в уравнение и найдем $Mr(MeSO_4)$:
$Mr(MeSO_4) = \frac{4 \cdot Ar(O)}{w(O)} = \frac{64}{0,5333} \approx 120$
Теперь найдем относительную атомную массу неизвестного металла:
$Ar(Me) = Mr(MeSO_4) - Mr(SO_4) = 120 - (32 + 4 \cdot 16) = 120 - 96 = 24$
Относительная атомная масса 24 соответствует металлу магнию ($Mg$), который является двухвалентным. Следовательно, искомый сульфат — это сульфат магния, $MgSO_4$.
2. Расчет массовой доли металла.
Теперь рассчитаем массовую долю магния ($Mg$) в сульфате магния ($MgSO_4$).
Относительная молекулярная масса $MgSO_4$ равна 120.
Массовая доля магния:
$w(Mg) = \frac{Ar(Mg)}{Mr(MgSO_4)} = \frac{24}{120} = 0,2$
Переведем в проценты:
$w(Mg) = 0,2 \cdot 100\% = 20\%$
Ответ: искомый металл — магний (Mg), его массовая доля в сульфате составляет 20%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 374 расположенного на странице 76 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №374 (с. 76), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














