Номер 748, страница 133 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 4. Металлы. Параграф 47. Соединения металлов. Оксиды и гидроксиды - номер 748, страница 133.
№748 (с. 133)
Условие. №748 (с. 133)
скриншот условия
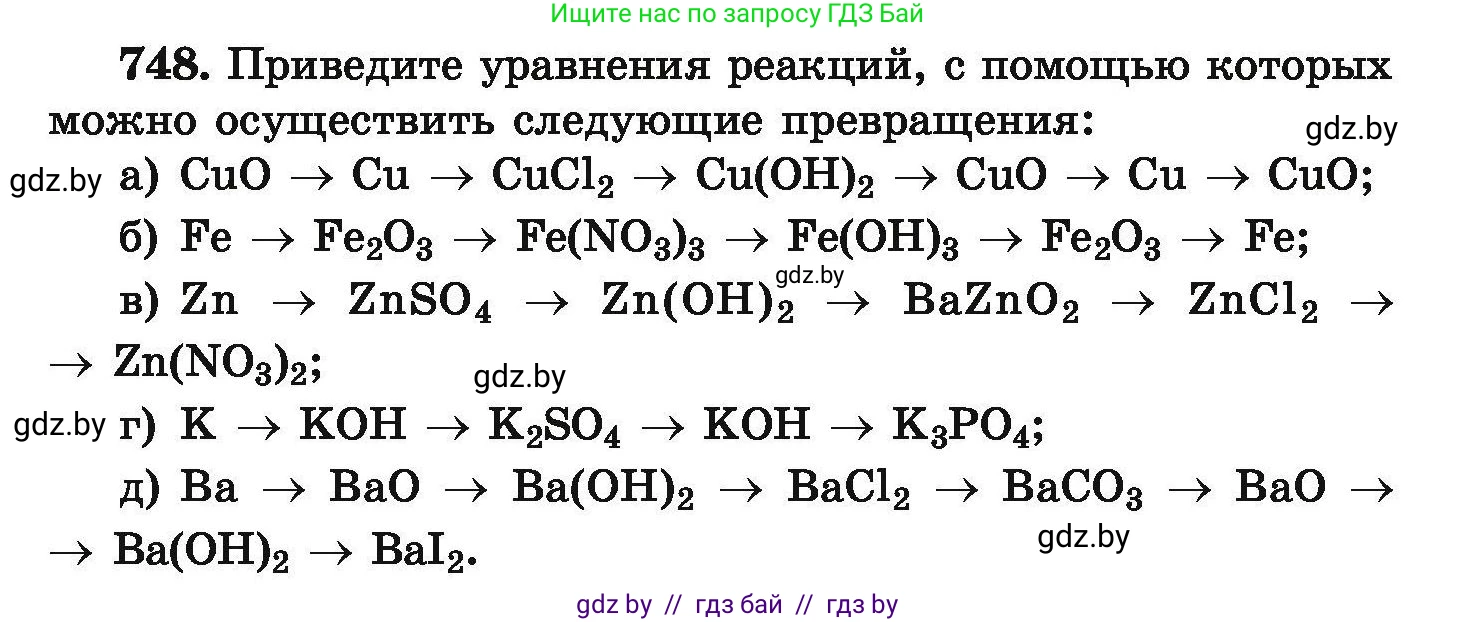
748. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $CuO \rightarrow Cu \rightarrow CuCl_2 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow Cu \rightarrow CuO;$
б) $Fe \rightarrow Fe_2O_3 \rightarrow Fe(NO_3)_3 \rightarrow Fe(OH)_3 \rightarrow Fe_2O_3 \rightarrow Fe;$
в) $Zn \rightarrow ZnSO_4 \rightarrow Zn(OH)_2 \rightarrow BaZnO_2 \rightarrow ZnCl_2 \rightarrow Zn(NO_3)_2;$
г) $K \rightarrow KOH \rightarrow K_2SO_4 \rightarrow KOH \rightarrow K_3PO_4;$
д) $Ba \rightarrow BaO \rightarrow Ba(OH)_2 \rightarrow BaCl_2 \rightarrow BaCO_3 \rightarrow BaO \rightarrow Ba(OH)_2 \rightarrow BaI_2.$
Решение. №748 (с. 133)


Решение 2. №748 (с. 133)
а) Решение:
1. Для получения меди из оксида меди(II) проведем реакцию восстановления с помощью водорода при нагревании:
$CuO + H_2 \xrightarrow{t} Cu + H_2O$
2. Медь реагирует с хлором при нагревании, образуя хлорид меди(II):
$Cu + Cl_2 \xrightarrow{t} CuCl_2$
3. Для получения гидроксида меди(II) к раствору хлорида меди(II) добавим щелочь, например, гидроксид натрия. Выпадет голубой осадок:
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + 2NaCl$
4. Гидроксид меди(II) при нагревании разлагается на оксид меди(II) и воду:
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
5. Повторно получим медь из ее оксида, на этот раз используя в качестве восстановителя углерод:
$2CuO + C \xrightarrow{t} 2Cu + CO_2 \uparrow$
6. Окисление меди кислородом при нагревании снова приводит к образованию оксида меди(II):
$2Cu + O_2 \xrightarrow{t} 2CuO$
Ответ:
$CuO + H_2 \xrightarrow{t} Cu + H_2O$
$Cu + Cl_2 \xrightarrow{t} CuCl_2$
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + 2NaCl$
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
$2CuO + C \xrightarrow{t} 2Cu + CO_2 \uparrow$
$2Cu + O_2 \xrightarrow{t} 2CuO$
б) Решение:
1. Железо сгорает в кислороде с образованием оксида железа(III):
$4Fe + 3O_2 \xrightarrow{t} 2Fe_2O_3$
2. Оксид железа(III) как основной оксид реагирует с кислотами, например с азотной кислотой, образуя соль и воду:
$Fe_2O_3 + 6HNO_3 \rightarrow 2Fe(NO_3)_3 + 3H_2O$
3. Для получения гидроксида железа(III) к раствору нитрата железа(III) добавим щелочь. Выпадет бурый осадок:
$Fe(NO_3)_3 + 3KOH \rightarrow Fe(OH)_3 \downarrow + 3KNO_3$
4. При нагревании гидроксид железа(III) разлагается:
$2Fe(OH)_3 \xrightarrow{t} Fe_2O_3 + 3H_2O$
5. Восстановление железа из оксида железа(III) можно провести угарным газом (процесс, аналогичный доменному):
$Fe_2O_3 + 3CO \xrightarrow{t} 2Fe + 3CO_2 \uparrow$
Ответ:
$4Fe + 3O_2 \xrightarrow{t} 2Fe_2O_3$
$Fe_2O_3 + 6HNO_3 \rightarrow 2Fe(NO_3)_3 + 3H_2O$
$Fe(NO_3)_3 + 3KOH \rightarrow Fe(OH)_3 \downarrow + 3KNO_3$
$2Fe(OH)_3 \xrightarrow{t} Fe_2O_3 + 3H_2O$
$Fe_2O_3 + 3CO \xrightarrow{t} 2Fe + 3CO_2 \uparrow$
в) Решение:
1. Цинк, как активный металл, стоящий до водорода в ряду напряжений, реагирует с разбавленной серной кислотой:
$Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \uparrow$
2. При добавлении щелочи к раствору сульфата цинка выпадает осадок гидроксида цинка(II):
$ZnSO_4 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + Na_2SO_4$
3. Гидроксид цинка амфотерен и при сплавлении с гидроксидом бария образует цинкат бария:
$Zn(OH)_2 + Ba(OH)_2 \xrightarrow{t} BaZnO_2 + 2H_2O$
4. Цинкат бария реагирует с соляной кислотой с образованием двух солей - хлорида бария и хлорида цинка:
$BaZnO_2 + 4HCl \rightarrow BaCl_2 + ZnCl_2 + 2H_2O$
5. Чтобы получить нитрат цинка из хлорида цинка, можно использовать реакцию обмена с нитратом серебра. Хлорид серебра выпадет в осадок:
$ZnCl_2 + 2AgNO_3 \rightarrow Zn(NO_3)_2 + 2AgCl \downarrow$
Ответ:
$Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \uparrow$
$ZnSO_4 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + Na_2SO_4$
$Zn(OH)_2 + Ba(OH)_2 \xrightarrow{t} BaZnO_2 + 2H_2O$
$BaZnO_2 + 4HCl \rightarrow BaCl_2 + ZnCl_2 + 2H_2O$
$ZnCl_2 + 2AgNO_3 \rightarrow Zn(NO_3)_2 + 2AgCl \downarrow$
г) Решение:
1. Калий - щелочной металл, бурно реагирует с водой с образованием гидроксида калия:
$2K + 2H_2O \rightarrow 2KOH + H_2 \uparrow$
2. Реакция нейтрализации между гидроксидом калия и серной кислотой приводит к образованию сульфата калия:
$2KOH + H_2SO_4 \rightarrow K_2SO_4 + 2H_2O$
3. Для получения гидроксида калия из его сульфата проведем реакцию обмена с гидроксидом бария. Сульфат бария выпадет в осадок, а в растворе останется гидроксид калия:
$K_2SO_4 + Ba(OH)_2 \rightarrow 2KOH + BaSO_4 \downarrow$
4. Нейтрализация полученного гидроксида калия ортофосфорной кислотой дает среднюю соль - ортофосфат калия:
$3KOH + H_3PO_4 \rightarrow K_3PO_4 + 3H_2O$
Ответ:
$2K + 2H_2O \rightarrow 2KOH + H_2 \uparrow$
$2KOH + H_2SO_4 \rightarrow K_2SO_4 + 2H_2O$
$K_2SO_4 + Ba(OH)_2 \rightarrow 2KOH + BaSO_4 \downarrow$
$3KOH + H_3PO_4 \rightarrow K_3PO_4 + 3H_2O$
д) Решение:
1. Барий, щелочноземельный металл, при нагревании на воздухе окисляется до оксида бария:
$2Ba + O_2 \xrightarrow{t} 2BaO$
2. Оксид бария активно реагирует с водой, образуя сильное основание - гидроксид бария:
$BaO + H_2O \rightarrow Ba(OH)_2$
3. В результате реакции нейтрализации гидроксида бария соляной кислотой образуется хлорид бария:
$Ba(OH)_2 + 2HCl \rightarrow BaCl_2 + 2H_2O$
4. Добавление к раствору хлорида бария раствора карбоната натрия приводит к выпадению белого осадка карбоната бария:
$BaCl_2 + Na_2CO_3 \rightarrow BaCO_3 \downarrow + 2NaCl$
5. Карбонат бария при сильном прокаливании разлагается на оксид бария и углекислый газ:
$BaCO_3 \xrightarrow{t} BaO + CO_2 \uparrow$
6. Повторно получаем гидроксид бария из оксида:
$BaO + H_2O \rightarrow Ba(OH)_2$
7. Для получения иодида бария проведем реакцию нейтрализации гидроксида бария иодоводородной кислотой:
$Ba(OH)_2 + 2HI \rightarrow BaI_2 + 2H_2O$
Ответ:
$2Ba + O_2 \xrightarrow{t} 2BaO$
$BaO + H_2O \rightarrow Ba(OH)_2$
$Ba(OH)_2 + 2HCl \rightarrow BaCl_2 + 2H_2O$
$BaCl_2 + Na_2CO_3 \rightarrow BaCO_3 \downarrow + 2NaCl$
$BaCO_3 \xrightarrow{t} BaO + CO_2 \uparrow$
$BaO + H_2O \rightarrow Ba(OH)_2$
$Ba(OH)_2 + 2HI \rightarrow BaI_2 + 2H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 748 расположенного на странице 133 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №748 (с. 133), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














