Номер 102, страница 24 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 4. Количественные характеристики вещества - номер 102, страница 24.
№102 (с. 24)
Условие. №102 (с. 24)
скриншот условия

102. Рассчитайте суммарное число атомов в порции, со-держащей:
а) 68,8 г тригидрата нитрата меди(II);
б) 240 мг медного купороса;
в) 12,6 кмоль декагидрата сульфата натрия;
г) $1,24 \cdot 10^3$ т малахита;
д) 450 кг гептагидрата сульфата железа(II).
Решение. №102 (с. 24)

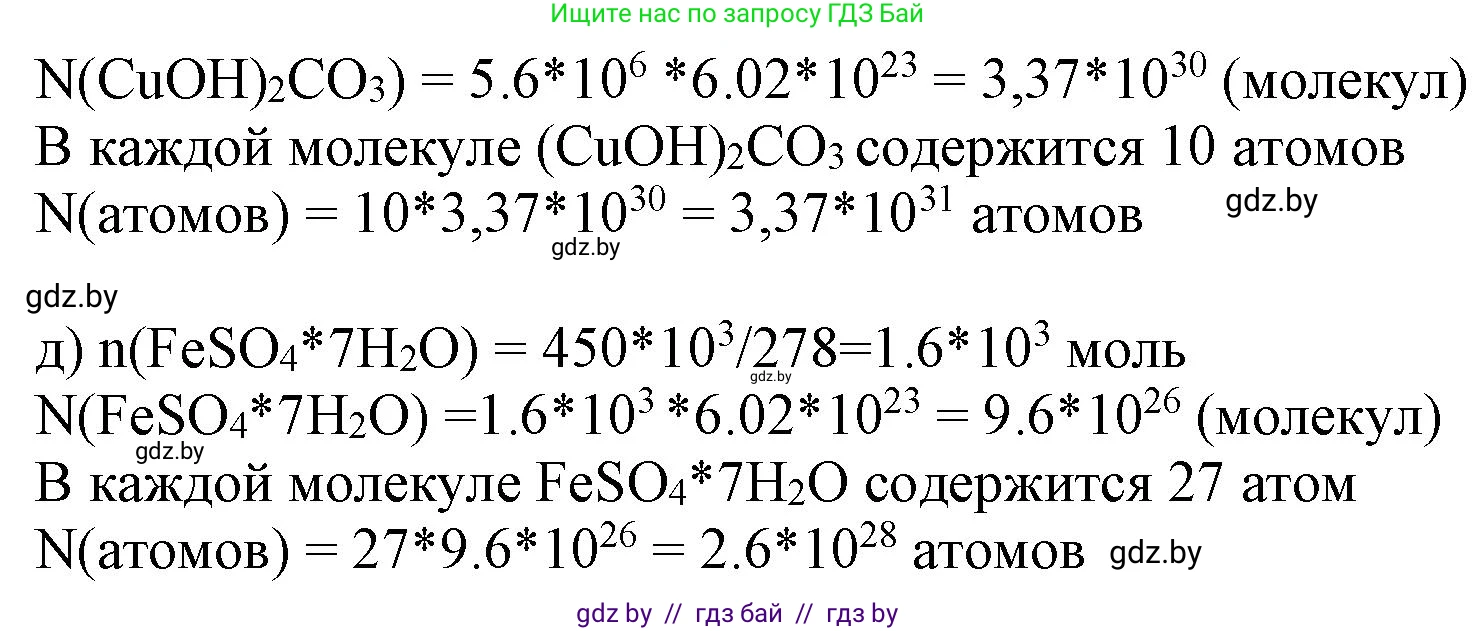
Решение 3. №102 (с. 24)
а) 68,8 г тригидрата нитрата меди(II)
Дано:
Масса тригидрата нитрата меди(II) $m(Cu(NO_3)_2 \cdot 3H_2O) = 68,8$ г
Постоянная Авогадро $N_A \approx 6,02 \cdot 10^{23}$ моль⁻¹
Найти:
Суммарное число атомов $N_{ат}$ - ?
Решение:
1. Запишем химическую формулу тригидрата нитрата меди(II): $Cu(NO_3)_2 \cdot 3H_2O$.
2. Рассчитаем число атомов в одной формульной единице ($N_ф$):
$N_ф = 1(Cu) + 2(N) + (2 \cdot 3 + 3)(O) + (3 \cdot 2)(H) = 1 + 2 + 9 + 6 = 18$ атомов.
3. Рассчитаем молярную массу $M$ тригидрата нитрата меди(II), используя относительные атомные массы: $Ar(Cu) \approx 63,5$, $Ar(N) \approx 14$, $Ar(O) \approx 16$, $Ar(H) \approx 1$.
$M(Cu(NO_3)_2 \cdot 3H_2O) = 63,5 + 2 \cdot (14 + 3 \cdot 16) + 3 \cdot (2 \cdot 1 + 16) = 63,5 + 2 \cdot 62 + 3 \cdot 18 = 63,5 + 124 + 54 = 241,5$ г/моль.
4. Найдем количество вещества $n$ в порции:
$n = \frac{m}{M} = \frac{68,8 \text{ г}}{241,5 \text{ г/моль}} \approx 0,285$ моль.
5. Рассчитаем суммарное число атомов $N_{ат}$ по формуле $N_{ат} = n \cdot N_A \cdot N_ф$ :
$N_{ат} = 0,285 \text{ моль} \cdot (6,02 \cdot 10^{23} \text{ моль⁻¹}) \cdot 18 \approx 3,09 \cdot 10^{24}$ атомов.
Ответ: $3,09 \cdot 10^{24}$ атомов.
б) 240 мг медного купороса
Дано:
Масса медного купороса $m(CuSO_4 \cdot 5H_2O) = 240$ мг
Перевод в СИ: $m = 240 \cdot 10^{-3} \text{ г} = 0,240$ г
Постоянная Авогадро $N_A \approx 6,02 \cdot 10^{23}$ моль⁻¹
Найти:
Суммарное число атомов $N_{ат}$ - ?
Решение:
1. Химическая формула медного купороса (пентагидрата сульфата меди(II)): $CuSO_4 \cdot 5H_2O$.
2. Рассчитаем число атомов в одной формульной единице ($N_ф$):
$N_ф = 1(Cu) + 1(S) + (4 + 5)(O) + (5 \cdot 2)(H) = 1 + 1 + 9 + 10 = 21$ атом.
3. Рассчитаем молярную массу $M$ медного купороса, используя относительные атомные массы: $Ar(Cu) \approx 63,5$, $Ar(S) \approx 32$, $Ar(O) \approx 16$, $Ar(H) \approx 1$.
$M(CuSO_4 \cdot 5H_2O) = 63,5 + 32 + 4 \cdot 16 + 5 \cdot (2 \cdot 1 + 16) = 63,5 + 32 + 64 + 5 \cdot 18 = 159,5 + 90 = 249,5$ г/моль.
4. Найдем количество вещества $n$ в порции:
$n = \frac{m}{M} = \frac{0,240 \text{ г}}{249,5 \text{ г/моль}} \approx 9,62 \cdot 10^{-4}$ моль.
5. Рассчитаем суммарное число атомов $N_{ат}$:
$N_{ат} = n \cdot N_A \cdot N_ф = (9,62 \cdot 10^{-4} \text{ моль}) \cdot (6,02 \cdot 10^{23} \text{ моль⁻¹}) \cdot 21 \approx 1,22 \cdot 10^{22}$ атомов.
Ответ: $1,22 \cdot 10^{22}$ атомов.
в) 12,6 кмоль декагидрата сульфата натрия
Дано:
Количество вещества декагидрата сульфата натрия $n(Na_2SO_4 \cdot 10H_2O) = 12,6$ кмоль
Перевод в СИ: $n = 12,6 \cdot 10^3 \text{ моль} = 12600$ моль
Постоянная Авогадро $N_A \approx 6,02 \cdot 10^{23}$ моль⁻¹
Найти:
Суммарное число атомов $N_{ат}$ - ?
Решение:
1. Химическая формула декагидрата сульфата натрия: $Na_2SO_4 \cdot 10H_2O$.
2. Рассчитаем число атомов в одной формульной единице ($N_ф$):
$N_ф = 2(Na) + 1(S) + (4 + 10)(O) + (10 \cdot 2)(H) = 2 + 1 + 14 + 20 = 37$ атомов.
3. Количество вещества $n$ уже дано, поэтому сразу переходим к расчету числа атомов $N_{ат}$:
$N_{ат} = n \cdot N_A \cdot N_ф = (1,26 \cdot 10^4 \text{ моль}) \cdot (6,02 \cdot 10^{23} \text{ моль⁻¹}) \cdot 37 \approx 2,81 \cdot 10^{29}$ атомов.
Ответ: $2,81 \cdot 10^{29}$ атомов.
г) 1,24 · 10³ т малахита
Дано:
Масса малахита $m = 1,24 \cdot 10^3$ т
Перевод в СИ: $m = 1,24 \cdot 10^3 \cdot 10^6 \text{ г} = 1,24 \cdot 10^9$ г
Постоянная Авогадро $N_A \approx 6,02 \cdot 10^{23}$ моль⁻¹
Найти:
Суммарное число атомов $N_{ат}$ - ?
Решение:
1. Химическая формула малахита (гидроксокарбоната меди(II)): $Cu_2(CO_3)(OH)_2$ или $(CuOH)_2CO_3$.
2. Рассчитаем число атомов в одной формульной единице ($N_ф$):
$N_ф = 2(Cu) + 1(C) + (3 + 2)(O) + 2(H) = 2 + 1 + 5 + 2 = 10$ атомов.
3. Рассчитаем молярную массу $M$ малахита, используя относительные атомные массы: $Ar(Cu) \approx 63,5$, $Ar(C) \approx 12$, $Ar(O) \approx 16$, $Ar(H) \approx 1$.
$M(Cu_2(CO_3)(OH)_2) = 2 \cdot 63,5 + 12 + 5 \cdot 16 + 2 \cdot 1 = 127 + 12 + 80 + 2 = 221$ г/моль.
4. Найдем количество вещества $n$ в порции:
$n = \frac{m}{M} = \frac{1,24 \cdot 10^9 \text{ г}}{221 \text{ г/моль}} \approx 5,61 \cdot 10^6$ моль.
5. Рассчитаем суммарное число атомов $N_{ат}$:
$N_{ат} = n \cdot N_A \cdot N_ф = (5,61 \cdot 10^6 \text{ моль}) \cdot (6,02 \cdot 10^{23} \text{ моль⁻¹}) \cdot 10 \approx 3,38 \cdot 10^{31}$ атомов.
Ответ: $3,38 \cdot 10^{31}$ атомов.
д) 450 кг гептагидрата сульфата железа(II)
Дано:
Масса гептагидрата сульфата железа(II) $m(FeSO_4 \cdot 7H_2O) = 450$ кг
Перевод в СИ: $m = 450 \cdot 10^3 \text{ г} = 4,5 \cdot 10^5$ г
Постоянная Авогадро $N_A \approx 6,02 \cdot 10^{23}$ моль⁻¹
Найти:
Суммарное число атомов $N_{ат}$ - ?
Решение:
1. Химическая формула гептагидрата сульфата железа(II) (железного купороса): $FeSO_4 \cdot 7H_2O$.
2. Рассчитаем число атомов в одной формульной единице ($N_ф$):
$N_ф = 1(Fe) + 1(S) + (4 + 7)(O) + (7 \cdot 2)(H) = 1 + 1 + 11 + 14 = 27$ атомов.
3. Рассчитаем молярную массу $M$ железного купороса, используя относительные атомные массы: $Ar(Fe) \approx 56$, $Ar(S) \approx 32$, $Ar(O) \approx 16$, $Ar(H) \approx 1$.
$M(FeSO_4 \cdot 7H_2O) = 56 + 32 + 4 \cdot 16 + 7 \cdot (2 \cdot 1 + 16) = 56 + 32 + 64 + 7 \cdot 18 = 152 + 126 = 278$ г/моль.
4. Найдем количество вещества $n$ в порции:
$n = \frac{m}{M} = \frac{4,5 \cdot 10^5 \text{ г}}{278 \text{ г/моль}} \approx 1618,7$ моль.
5. Рассчитаем суммарное число атомов $N_{ат}$:
$N_{ат} = n \cdot N_A \cdot N_ф = 1618,7 \text{ моль} \cdot (6,02 \cdot 10^{23} \text{ моль⁻¹}) \cdot 27 \approx 2,63 \cdot 10^{28}$ атомов.
Ответ: $2,63 \cdot 10^{28}$ атомов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 102 расположенного на странице 24 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №102 (с. 24), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














