Номер 303, страница 49 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 2. Строение атома и периодический закон. Параграф 12. Значение периодического закона и периодической системы Д. И. Менделеева для развития науки - номер 303, страница 49.
№303 (с. 49)
Условие. №303 (с. 49)
скриншот условия

303. Составьте электронные формулы:
а) аргона;
б) калия;
в) катиона кальция;
г) аниона фтора.
Решение. №303 (с. 49)
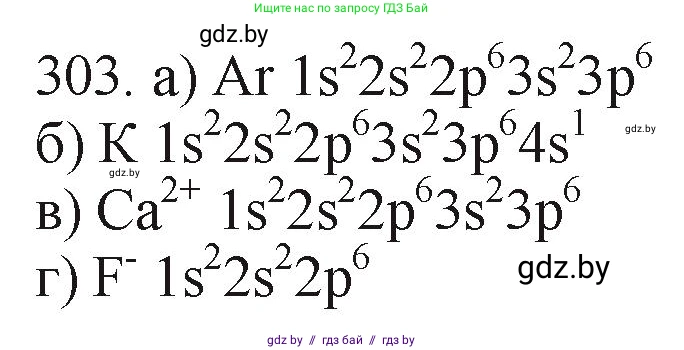
Решение 3. №303 (с. 49)
а) аргона
Атом аргона (Ar) — химический элемент с порядковым номером 18 в Периодической системе Д.И. Менделеева. Это означает, что ядро атома аргона содержит 18 протонов, а в нейтральном атоме вокруг ядра движутся 18 электронов.
Электроны заполняют атомные орбитали в порядке возрастания их энергии согласно принципу Паули и правилу Клечковского.
Распределение 18 электронов по энергетическим уровням и подуровням выглядит следующим образом:
$1s^2 2s^2 2p^6 3s^2 3p^6$
На первом энергетическом уровне находится 2 электрона ($1s^2$).
На втором энергетическом уровне — 8 электронов ($2s^2 2p^6$).
На третьем, внешнем, энергетическом уровне — 8 электронов ($3s^2 3p^6$). Этот уровень является завершенным, что объясняет химическую инертность аргона.
Ответ: $1s^2 2s^2 2p^6 3s^2 3p^6$.
б) калия
Атом калия (K) имеет порядковый номер 19. Следовательно, в нейтральном атоме калия содержится 19 протонов и 19 электронов.
Электронная конфигурация калия строится на основе конфигурации предыдущего инертного газа, аргона ($1s^2 2s^2 2p^6 3s^2 3p^6$).
Девятнадцатый электрон, согласно правилу Клечковского (принцип наименьшей энергии), занимает $4s$-подуровень, а не $3d$, так как энергия $4s$-орбитали ниже энергии $3d$-орбитали.
Таким образом, полная электронная формула калия:
$1s^2 2s^2 2p^6 3s^2 3p^6 4s^1$
Ответ: $1s^2 2s^2 2p^6 3s^2 3p^6 4s^1$.
в) катиона кальция
Атом кальция (Ca) имеет порядковый номер 20, что соответствует 20 протонам и 20 электронам в нейтральном состоянии. Его электронная формула: $1s^2 2s^2 2p^6 3s^2 3p^6 4s^2$.
Катион кальция ($Ca^{2+}$) образуется в результате потери атомом кальция двух электронов с внешнего энергетического уровня. Внешним для кальция является четвертый уровень, представленный $4s$-подуровнем.
После потери двух электронов ион $Ca^{2+}$ будет иметь $20 - 2 = 18$ электронов.
Его электронная конфигурация становится такой же, как у атома аргона (Ar), что является энергетически выгодным состоянием с завершенным внешним электронным слоем.
Электронная формула катиона кальция:
$1s^2 2s^2 2p^6 3s^2 3p^6$
Ответ: $1s^2 2s^2 2p^6 3s^2 3p^6$.
г) аниона фтора
Атом фтора (F) имеет порядковый номер 9, следовательно, у него 9 протонов и 9 электронов. Электронная формула нейтрального атома фтора: $1s^2 2s^2 2p^5$. На внешнем ($2p$) подуровне не хватает одного электрона до его полного завершения (до 6).
Анион фтора, или фторид-ион ($F^{-}$), образуется при присоединении одного электрона к атому фтора. Этот электрон занимает вакантное место на $2p$-подуровне.
В результате у иона $F^{-}$ становится $9 + 1 = 10$ электронов.
Его электронная конфигурация становится такой же, как у инертного газа неона (Ne), $1s^2 2s^2 2p^6$, с завершенным внешним электронным слоем.
Электронная формула аниона фтора:
$1s^2 2s^2 2p^6$
Ответ: $1s^2 2s^2 2p^6$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 303 расположенного на странице 49 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №303 (с. 49), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














