Номер 310, страница 50 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 2. Строение атома и периодический закон. Параграф 12. Значение периодического закона и периодической системы Д. И. Менделеева для развития науки - номер 310, страница 50.
№310 (с. 50)
Условие. №310 (с. 50)
скриншот условия

310. Соль какой массы образуется при взаимодействии высшего оксида кальция массой 6,00 г с высшим оксидом углерода объёмом (н. у.) $2,24 \text{ дм}^3$?
Решение. №310 (с. 50)
Решение 3. №310 (с. 50)
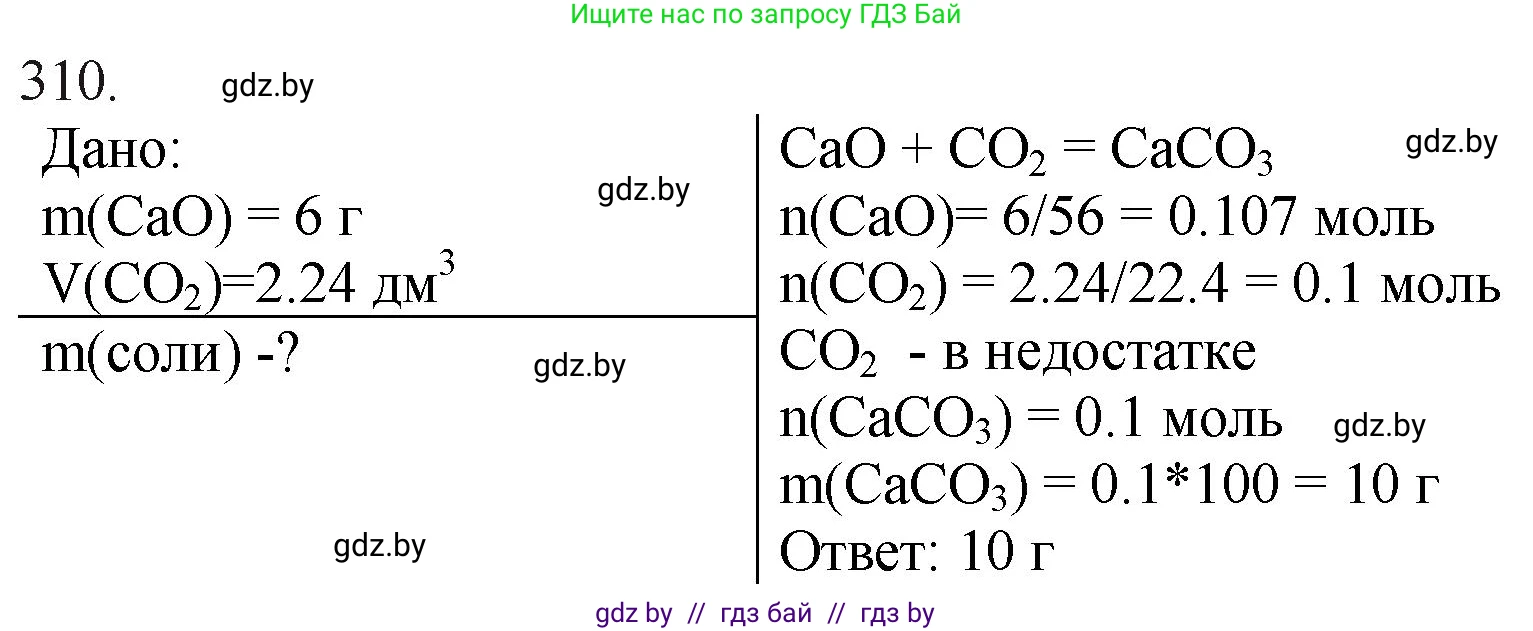
Дано:
$m(\text{высшего оксида кальция}) = 6,00 \text{ г}$
$V(\text{высшего оксида углерода}) = 2,24 \text{ дм}^3$ (н. у.)
Найти:
$m(\text{соли}) - ?$
Решение:
Высший оксид кальция — это оксид кальция (II) с формулой $CaO$, так как кальций является элементом II группы Периодической системы и проявляет высшую степень окисления +2. Высший оксид углерода — это оксид углерода (IV) с формулой $CO_2$, так как углерод является элементом IV группы и проявляет высшую степень окисления +4.
При взаимодействии основного оксида $CaO$ с кислотным оксидом $CO_2$ образуется соль — карбонат кальция $CaCO_3$. Запишем уравнение реакции:
$CaO + CO_2 \rightarrow CaCO_3$
Из уравнения видно, что реагенты взаимодействуют в мольном соотношении $1:1$.
Поскольку в задаче даны количества обоих реагентов, необходимо определить, который из них находится в недостатке. Для этого рассчитаем количество вещества каждого реагента.
Молярная масса оксида кальция: $M(\text{CaO}) = 40,08 + 16,00 = 56,08 \text{ г/моль}$.
Количество вещества оксида кальция:
$n(\text{CaO}) = \frac{m(\text{CaO})}{M(\text{CaO})} = \frac{6,00 \text{ г}}{56,08 \text{ г/моль}} \approx 0,107 \text{ моль}$
Объём оксида углерода(IV) дан при нормальных условиях (н. у.), поэтому для расчета его количества вещества используем молярный объем газов $V_m = 22,4 \text{ дм}^3/\text{моль}$.
Количество вещества оксида углерода(IV):
$n(\text{CO}_2) = \frac{V(\text{CO}_2)}{V_m} = \frac{2,24 \text{ дм}^3}{22,4 \text{ дм}^3/\text{моль}} = 0,100 \text{ моль}$
Сравним полученные количества веществ: $n(\text{CO}_2) = 0,100 \text{ моль}$, а $n(\text{CaO}) \approx 0,107 \text{ моль}$. Так как для реакции требуется равное мольное количество реагентов, оксид углерода(IV) находится в недостатке ($0,100 < 0,107$), а оксид кальция — в избытке. Расчет массы продукта реакции следует вести по веществу, находящемуся в недостатке, то есть по $CO_2$.
Согласно уравнению реакции, из 1 моль $CO_2$ образуется 1 моль $CaCO_3$. Следовательно, количество вещества образовавшегося карбоната кальция равно количеству вещества прореагировавшего $CO_2$:
$n(\text{CaCO}_3) = n(\text{CO}_2) = 0,100 \text{ моль}$
Теперь рассчитаем массу образовавшейся соли. Молярная масса карбоната кальция: $M(\text{CaCO}_3) = 40,08 + 12,01 + 3 \cdot 16,00 = 100,09 \text{ г/моль}$.
Масса карбоната кальция:
$m(\text{CaCO}_3) = n(\text{CaCO}_3) \times M(\text{CaCO}_3) = 0,100 \text{ моль} \times 100,09 \text{ г/моль} = 10,009 \text{ г}$
Исходные данные приведены с тремя значащими цифрами ($6,00$ и $2,24$), поэтому ответ следует округлить до трех значащих цифр.
Ответ: масса образовавшейся соли равна 10,0 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 310 расположенного на странице 50 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №310 (с. 50), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














