Номер 359, страница 56 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 13. Природа и типы химической связи - номер 359, страница 56.
№359 (с. 56)
Условие. №359 (с. 56)
скриншот условия

359. *Образец сульфата массой 28,4 г содержит ионы химическим количеством 0,60 моль. Установите химическую формулу сульфата.
Решение. №359 (с. 56)
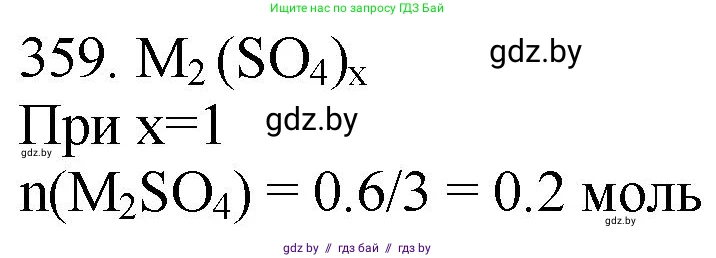

Решение 3. №359 (с. 56)
Дано:
$m(\text{сульфата}) = 28,4 \text{ г}$
$n(\text{ионов}) = 0,60 \text{ моль}$
Найти:
Химическую формулу сульфата - ?
Решение:
1. Обозначим общую формулу сульфата как $Me_x(SO_4)_y$, где $Me$ – это катион (металл или аммоний), а $x$ и $y$ – стехиометрические индексы. При диссоциации 1 моль этого вещества образуется $x$ моль катионов $Me$ и $y$ моль сульфат-анионов $SO_4^{2-}$.
Уравнение диссоциации в общем виде: $Me_x(SO_4)_y \rightarrow x Me^{z+} + y SO_4^{2-}$
Общее химическое количество ионов, образующихся из $n$ моль сульфата, равно: $n(\text{ионов}) = n(Me^{z+}) + n(SO_4^{2-}) = x \cdot n(Me_x(SO_4)_y) + y \cdot n(Me_x(SO_4)_y) = (x+y) \cdot n(Me_x(SO_4)_y)$
2. Из этого соотношения можно выразить химическое количество самого сульфата: $n(Me_x(SO_4)_y) = \frac{n(\text{ионов})}{x+y} = \frac{0,60}{x+y} \text{ моль}$
3. Зная массу образца и химическое количество, найдем молярную массу сульфата $M(Me_x(SO_4)_y)$: $M(Me_x(SO_4)_y) = \frac{m(Me_x(SO_4)_y)}{n(Me_x(SO_4)_y)} = \frac{28,4 \text{ г}}{\frac{0,60}{x+y} \text{ моль}} = \frac{28,4 \cdot (x+y)}{0,60} \text{ г/моль}$
4. Рассмотрим возможные варианты валентности катиона $Me$ и соответствующей формулы сульфата.
Случай 1: Катион одновалентен ($z=1$). Формула сульфата будет $Me_2SO_4$. Здесь $x=2$, $y=1$. Рассчитаем молярную массу этого сульфата: $M(Me_2SO_4) = \frac{28,4 \cdot (2+1)}{0,60} = \frac{28,4 \cdot 3}{0,60} = \frac{85,2}{0,60} = 142 \text{ г/моль}$ Молярная масса сульфата также равна сумме молярных масс его составляющих: $M(Me_2SO_4) = 2 \cdot M(Me) + M(SO_4)$ Молярная масса сульфат-иона $M(SO_4) = M(S) + 4 \cdot M(O) = 32 + 4 \cdot 16 = 96 \text{ г/моль}$. Найдем молярную массу катиона $M(Me)$: $142 = 2 \cdot M(Me) + 96$ $2 \cdot M(Me) = 142 - 96 = 46$ $M(Me) = \frac{46}{2} = 23 \text{ г/моль}$ Элемент с такой молярной массой — натрий (Na), который является одновалентным металлом. Таким образом, этот вариант является верным. Формула сульфата — $Na_2SO_4$ (сульфат натрия).
Случай 2: Катион двухвалентен ($z=2$). Формула сульфата будет $MeSO_4$. Здесь $x=1$, $y=1$. Рассчитаем молярную массу: $M(MeSO_4) = \frac{28,4 \cdot (1+1)}{0,60} = \frac{28,4 \cdot 2}{0,60} = \frac{56,8}{0,60} \approx 94,67 \text{ г/моль}$ Найдем молярную массу катиона $M(Me)$: $M(Me) = M(MeSO_4) - M(SO_4) = 94,67 - 96 = -1,33 \text{ г/моль}$ Молярная масса не может быть отрицательной, следовательно, этот случай невозможен.
Случай 3: Катион трехвалентен ($z=3$). Формула сульфата будет $Me_2(SO_4)_3$. Здесь $x=2$, $y=3$. Рассчитаем молярную массу: $M(Me_2(SO_4)_3) = \frac{28,4 \cdot (2+3)}{0,60} = \frac{28,4 \cdot 5}{0,60} = \frac{142}{0,60} \approx 236,67 \text{ г/моль}$ Найдем молярную массу катиона $M(Me)$: $2 \cdot M(Me) = M(Me_2(SO_4)_3) - 3 \cdot M(SO_4) = 236,67 - 3 \cdot 96 = 236,67 - 288 = -51,33 \text{ г/моль}$ Молярная масса не может быть отрицательной, этот случай также невозможен.
5. Единственный физически осмысленный результат получен для сульфата одновалентного металла натрия.
Ответ: $Na_2SO_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 359 расположенного на странице 56 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №359 (с. 56), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














