Номер 375, страница 58 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 14. Свойства химических связей - номер 375, страница 58.
№375 (с. 58)
Условие. №375 (с. 58)
скриншот условия

375. Приведите электронную формулу и электронно-графическую схему атома углерода в невозбуждённом и возбуждённом состояниях. Какое число химических связей и какого типа может образовывать атом углерода в возбуждённом состоянии с другими атомами?
Решение. №375 (с. 58)
Решение 3. №375 (с. 58)
Атом углерода ($C$) находится во втором периоде, IVА группе периодической системы, его порядковый номер 6. Следовательно, заряд ядра атома углерода равен +6, и на его электронной оболочке находится 6 электронов.
Электронная формула и электронно-графическая схема атома углерода в невозбуждённом состоянии
В основном, или невозбуждённом, состоянии электроны углерода распределяются по орбиталям в соответствии с принципом наименьшей энергии.
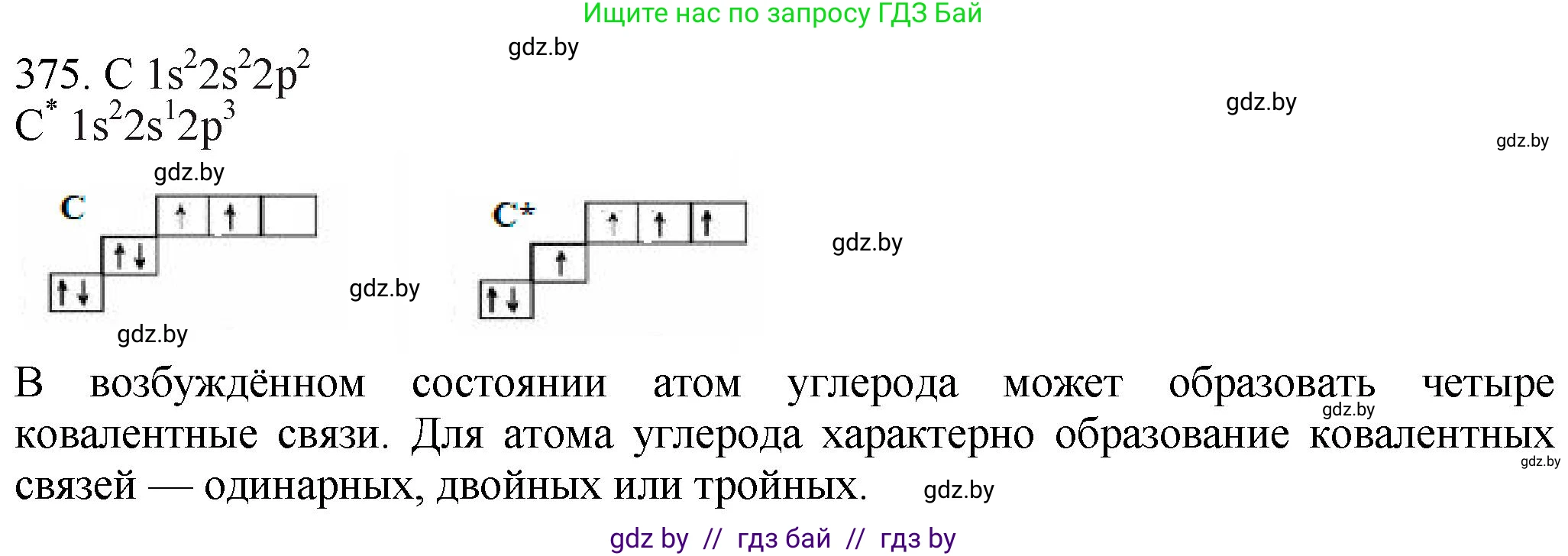
Электронная формула: $1s^22s^22p^2$.
Электронно-графическая схема валентного уровня ($2s^22p^2$):
| 2p | ↑ | ↑ | |
| 2s | ↑↓ | ||
| Энергия → | |||
В невозбуждённом состоянии атом углерода имеет два неспаренных электрона на внешнем уровне, что соответствует валентности II.
Ответ: Электронная формула в невозбуждённом состоянии – $1s^22s^22p^2$. Электронно-графическая схема валентных электронов показывает наличие одной спаренной электронной пары на 2s-подуровне и двух неспаренных электронов на 2p-подуровне.
Электронная формула и электронно-графическая схема атома углерода в возбуждённом состоянии
При поглощении энергии (например, при химической реакции) атом углерода переходит в возбуждённое состояние. Один из электронов с 2s-орбитали переходит на свободную 2p-орбиталь.
Электронная формула: $1s^22s^12p^3$. Обозначается как $C^*$.
Электронно-графическая схема валентного уровня ($2s^12p^3$):
| 2p | ↑ | ↑ | ↑ |
| 2s | ↑ | ||
| Энергия → | |||
В возбуждённом состоянии атом углерода имеет четыре неспаренных электрона, что позволяет ему проявлять валентность IV, характерную для большинства его соединений.
Ответ: Электронная формула в возбуждённом состоянии – $1s^22s^12p^3$. Электронно-графическая схема валентных электронов показывает наличие четырёх неспаренных электронов: одного на 2s-подуровне и трёх на 2p-подуровне.
Число и тип химических связей, образуемых атомом углерода в возбуждённом состоянии
В возбуждённом состоянии атом углерода ($C^*$) имеет четыре неспаренных электрона на валентном уровне. Благодаря этому он может образовывать четыре ковалентные химические связи по обменному механизму.
Эти четыре связи могут быть разного типа в зависимости от гибридизации атомных орбиталей углерода.
- При sp³-гибридизации атом углерода образует четыре одинарные сигма-связи ($\sigma$-связи), направленные к вершинам тетраэдра (например, в метане $CH_4$).
- При sp²-гибридизации атом углерода образует три $\sigma$-связи и одну пи-связь ($\pi$-связь). Это приводит к образованию одной двойной и двух одинарных связей (например, в этене $C_2H_4$).
- При sp-гибридизации атом углерода образует две $\sigma$-связи и две $\pi$-связи. Это приводит к образованию одной тройной и одной одинарной связи (например, в этине $C_2H_2$) или двух двойных связей (например, в диоксиде углерода $CO_2$).
Таким образом, атом углерода в возбуждённом состоянии образует связи двух типов: сигма ($\sigma$) и пи ($\pi$).
Ответ: Атом углерода в возбуждённом состоянии может образовывать четыре химические связи с другими атомами. Эти связи являются ковалентными и могут быть как сигма ($\sigma$), так и пи ($\pi$) типами, формируя одинарные, двойные или тройные связи.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 375 расположенного на странице 58 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №375 (с. 58), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














