Номер 368, страница 57 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 14. Свойства химических связей - номер 368, страница 57.
№368 (с. 57)
Условие. №368 (с. 57)
скриншот условия

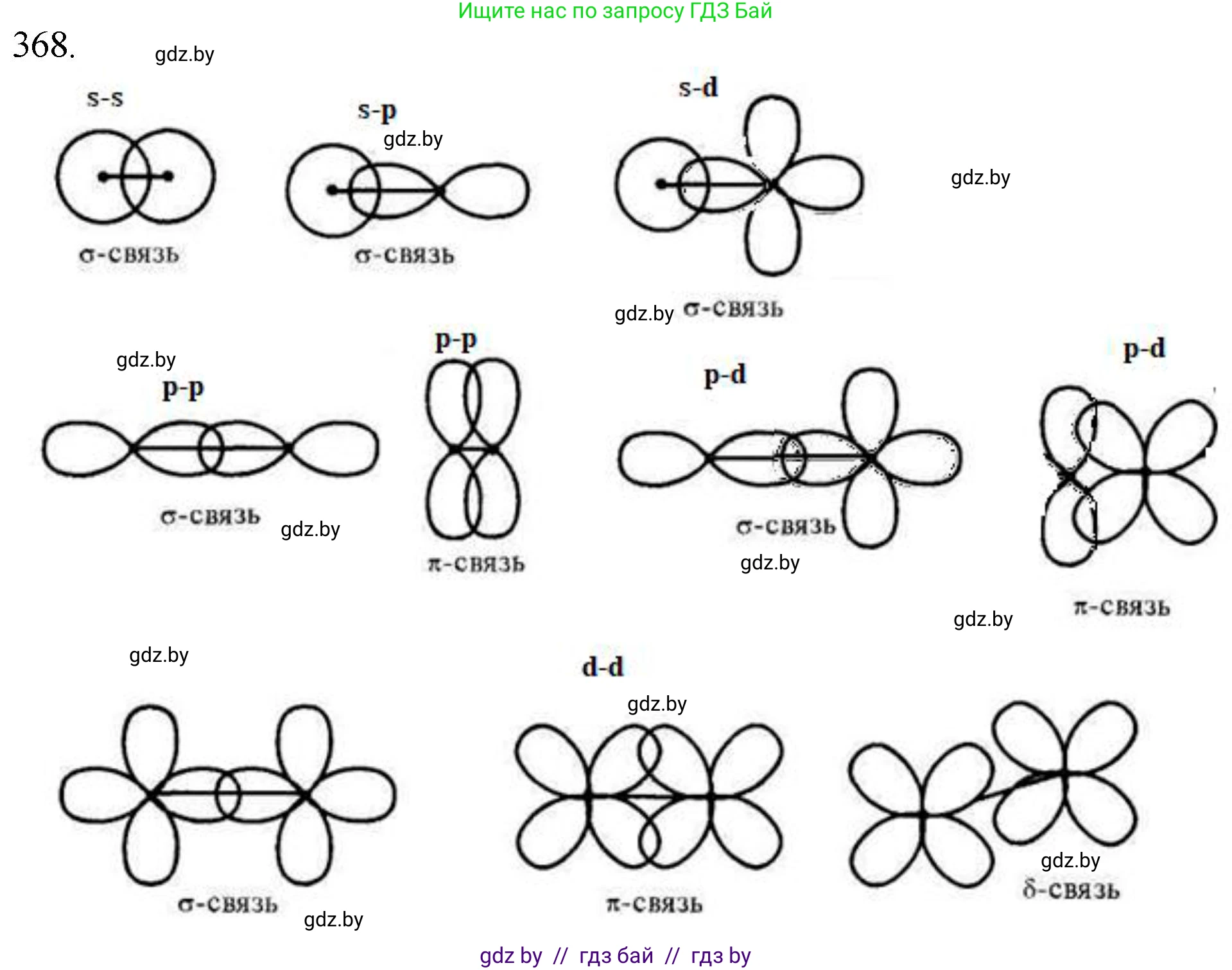
368. При образовании ковалентных химических связей $s$-, $p$- и $d$-электронные орбитали могут перекрываться между собой. Приведите все возможные комбинации типов перекрываний указанных орбиталей. Какие из них могут образовывать $\sigma$-связи, а какие — $\pi$-связи?
Решение. №368 (с. 57)
Решение 3. №368 (с. 57)
При образовании ковалентных химических связей s-, p- и d-электронные орбитали могут перекрываться различными способами. Ковалентная связь образуется в результате перекрывания атомных орбиталей, а тип связи ($\sigma$, $\pi$ или $\delta$) зависит от симметрии этого перекрывания относительно межъядерной оси (линии, соединяющей центры атомов).
Всего существует 6 основных парных комбинаций перекрывания указанных орбиталей: s-s, s-p, s-d, p-p, p-d, d-d.
Комбинации, образующие $\sigma$-связи$\sigma$-связь (сигма-связь) — это ковалентная связь, образованная при "осевом" или "лобовом" перекрывании атомных орбиталей. При этом максимальная электронная плотность концентрируется вдоль межъядерной оси. $\sigma$-связи являются наиболее прочными и образуются первыми при формировании двойных или тройных связей.
$\sigma$-связи могут образовывать следующие комбинации перекрываний:
- s-s перекрывание: две сферические s-орбитали перекрываются вдоль линии, соединяющей их центры.
- s-p перекрывание: s-орбиталь одного атома перекрывается с p-орбиталью другого атома, ориентированной вдоль межъядерной оси (например, pz-орбиталью, если ось связи — z).
- s-d перекрывание: s-орбиталь одного атома перекрывается с d-орбиталью другого атома, имеющей значительную электронную плотность вдоль межъядерной оси (например, с dz²-орбиталью).
- p-p перекрывание: две p-орбитали, ориентированные вдоль межъядерной оси (например, две pz-орбитали), перекрываются "конец в конец".
- p-d перекрывание: p-орбиталь (например, pz) одного атома перекрывается с d-орбиталью (например, dz²) другого атома по межъядерной оси.
- d-d перекрывание: две d-орбитали (например, две dz²-орбитали) перекрываются вдоль межъядерной оси.
Ответ: $\sigma$-связи могут образовываться при перекрывании следующих типов орбиталей: s-s, s-p, s-d, p-p, p-d, d-d.
Комбинации, образующие $\pi$-связи$\pi$-связь (пи-связь) — это ковалентная связь, которая образуется при "боковом" перекрывании p- или d-орбиталей. При этом образуются две области перекрывания, расположенные по обе стороны от межъядерной оси (в узловой плоскости $\sigma$-связи). $\pi$-связи образуются только после формирования $\sigma$-связи и входят в состав кратных (двойных и тройных) связей. s-орбитали не могут образовывать $\pi$-связи из-за своей сферической симметрии.
$\pi$-связи могут образовывать следующие комбинации:
- p-p перекрывание: две параллельные друг другу p-орбитали (например, две px- или две py-орбитали), перпендикулярные межъядерной оси, перекрываются боками.
- p-d перекрывание: p-орбиталь одного атома (например, px) перекрывается боками с подходящей по симметрии d-орбиталью другого атома (например, dxz).
- d-d перекрывание: две параллельные d-орбитали (например, две dxz- или две dyz-орбитали) перекрываются боками. Стоит отметить, что при боковом перекрывании четырех долей d-орбиталей (например, dxy с dxy или dx²-y² с dx²-y²) может также образовываться $\delta$-связь (дельта-связь), которая является еще одним типом ковалентной связи.
Ответ: $\pi$-связи могут образовываться при перекрывании следующих типов орбиталей: p-p, p-d, d-d.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 368 расположенного на странице 57 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №368 (с. 57), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














