Номер 370, страница 58 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 14. Свойства химических связей - номер 370, страница 58.
№370 (с. 58)
Условие. №370 (с. 58)
скриншот условия

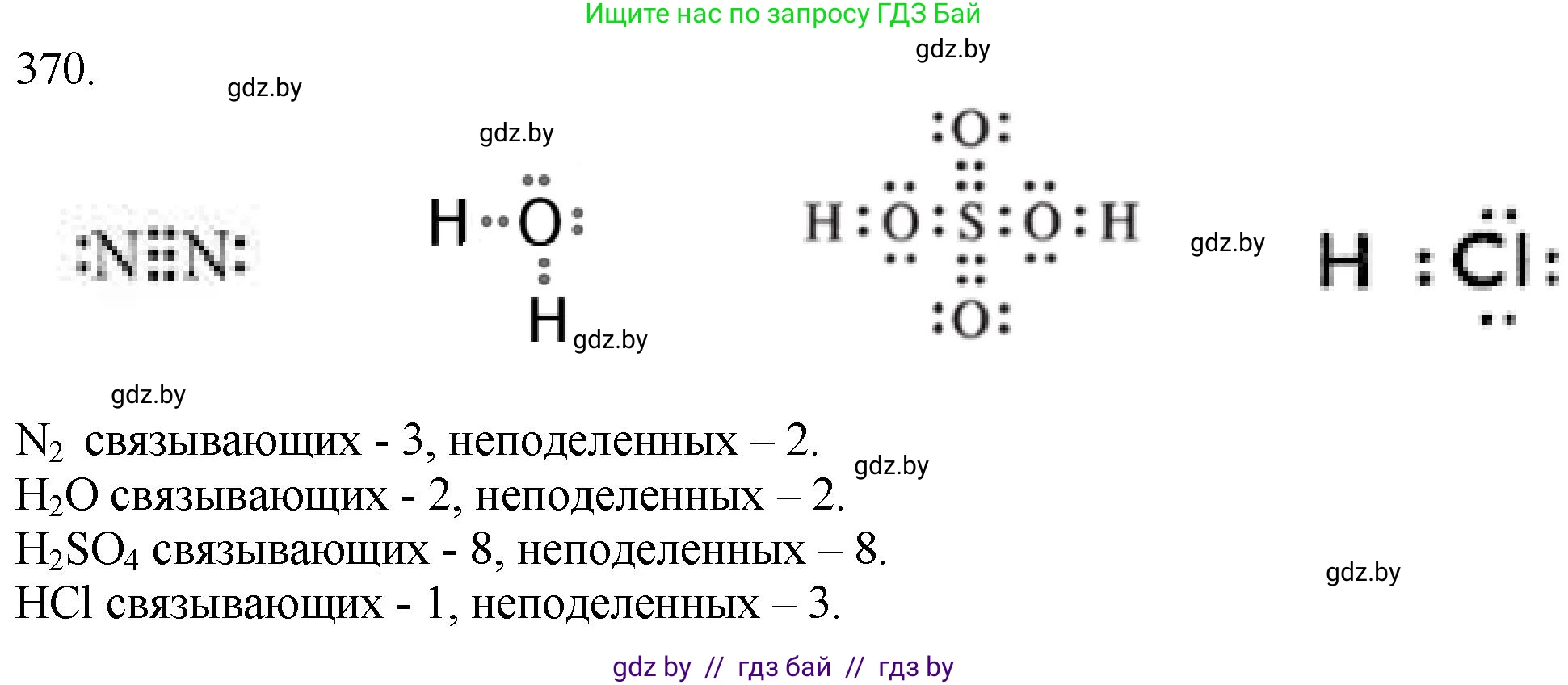
370. Какое число связывающих и неподелённых электронных пар имеется в молекулах $N_2$, $H_2O$, $H_2SO_4$, $HCl$?
Решение. №370 (с. 58)
Решение 3. №370 (с. 58)
Чтобы определить число связывающих и неподеленных электронных пар, необходимо рассмотреть электронное строение (структуры Льюиса) для каждой из указанных молекул. Связывающие пары — это электроны, образующие ковалентные связи между атомами, а неподеленные — это валентные электроны, принадлежащие одному атому и не участвующие в образовании связей.
Азот ($N_2$)
Атом азота (N) является элементом 15-й группы и имеет 5 валентных электронов. В молекуле $N_2$ два атома азота соединены тройной ковалентной связью ($N \equiv N$) для достижения стабильной восьмиэлектронной оболочки (октета) у каждого атома. Тройная связь состоит из трех общих электронных пар, следовательно, в молекуле азота 3 связывающие электронные пары. Каждый атом азота использует по 3 электрона для образования связей, и у каждого остается по $5-3=2$ электрона, которые образуют одну неподеленную электронную пару. Таким образом, в молекуле две неподеленные электронные пары (по одной на каждом атоме азота).
Ответ: в молекуле азота 3 связывающие электронные пары и 2 неподеленные электронные пары.
Вода ($H_2O$)
Атом кислорода (O) — элемент 16-й группы с 6 валентными электронами. Атом водорода (H) имеет 1 валентный электрон. В молекуле воды атом кислорода образует две одинарные ковалентные связи с двумя атомами водорода ($H-O-H$). Эти две одинарные связи составляют 2 связывающие электронные пары. Атом кислорода тратит 2 своих валентных электрона на образование связей, а оставшиеся $6-2=4$ электрона образуют две неподеленные электронные пары на атоме кислорода. Атомы водорода неподеленных пар не имеют.
Ответ: в молекуле воды 2 связывающие электронные пары и 2 неподеленные электронные пары.
Серная кислота ($H_2SO_4$)
В молекуле серной кислоты центральным атомом является сера (S, 6 валентных электронов), связанная с четырьмя атомами кислорода (О, по 6 валентных электронов). Два атома водорода (Н, по 1 валентному электрону) присоединены к двум атомам кислорода. Согласно строению молекулы, атом серы образует две двойные связи с двумя атомами кислорода и две одинарные связи с двумя гидроксильными группами (-OH). Подсчитаем связывающие пары: две двойные связи $S=O$ (это $2 \times 2 = 4$ пары), две одинарные связи $S-O$ (2 пары) и две одинарные связи $O-H$ (2 пары). Итого: $4 + 2 + 2 = 8$ связывающих электронных пар. Теперь подсчитаем неподеленные пары: на двух атомах кислорода, связанных с серой двойной связью, имеется по 2 неподеленные пары (всего $2 \times 2 = 4$ пары); на двух атомах кислорода в гидроксильных группах также имеется по 2 неподеленные пары (всего $2 \times 2 = 4$ пары). Атом серы и атомы водорода неподеленных пар не имеют. Итого: $4 + 4 = 8$ неподеленных электронных пар.
Ответ: в молекуле серной кислоты 8 связывающих электронных пар и 8 неподеленных электронных пар.
Хлороводород ($HCl$)
Атом хлора (Cl) — элемент 17-й группы с 7 валентными электронами, а атом водорода (H) имеет 1 валентный электрон. Между ними образуется одна одинарная ковалентная связь ($H-Cl$). Эта связь представляет собой 1 связывающую электронную пару. Атом хлора использует 1 электрон для связи, а остальные $7-1=6$ электронов образуют три неподеленные электронные пары. Атом водорода неподеленных пар не имеет.
Ответ: в молекуле хлороводорода 1 связывающая электронная пара и 3 неподеленные электронные пары.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 370 расположенного на странице 58 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №370 (с. 58), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














