Номер 398, страница 61 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 14. Свойства химических связей. 1. *Гибридизация атомных орбиталей - номер 398, страница 61.
№398 (с. 61)
Условие. №398 (с. 61)
скриншот условия

398. *Укажите верные утверждения:
а) гибридизация между $1s$- и $2s$-орбиталями невозможна;
б) частица $AB_2$, в которой центральный атом $A$ находится в $sp$-гибридном состоянии, имеет угловую форму;
в) атомы азота в нитрат-ионе находятся в $sp^2$-гибридном состоянии;
г) молекула метана имеет форму тетраэдра, в вершинах которого расположены атомы углерода, а в центре — атом водорода;
д) гибридизация атомов, расположенных в третьем периоде и далее, затруднена;
е) частица, центральный атом которой находится в $sp^2$-гибридном состоянии, имеет форму плоского треугольника;
ж) в молекулах органических соединений атомы углерода могут быть только в $sp^3$-гибридном состоянии;
з) все атомы в молекуле этилена расположены в одной плоскости.
Решение. №398 (с. 61)
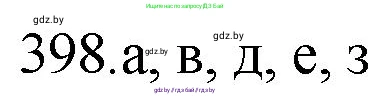
Решение 3. №398 (с. 61)
а) гибридизация между 1s- и 2s-орбиталями невозможна;
Гибридизация — это концепция смешения атомных орбиталей одного атома, близких по энергии, для образования новых, гибридных орбиталей, одинаковых по форме и энергии. Ключевым условием является близость энергетических уровней смешивающихся орбиталей. Орбитали $1s$ и $2s$ принадлежат к разным главным энергетическим уровням ($n=1$ и $n=2$). Разница в их энергиях значительна, что делает их гибридизацию невозможной. В атомах элементов второго периода $1s$-орбиталь является внутренней (остовной) и не участвует в образовании химических связей, в то время как валентными являются $2s$- и $2p$-орбитали.
Ответ: верно.
б) частица AB₂, в которой центральный атом A находится в sp-гибридном состоянии, имеет угловую форму;
$sp$-гибридизация центрального атома $A$ приводит к образованию двух гибридных орбиталей, которые для минимизации взаимного отталкивания располагаются на одной прямой под углом $180°$ друг к другу. Если эти две орбитали образуют связи с двумя атомами $B$, то геометрия частицы $AB_2$ будет линейной. Примерами могут служить $BeH_2$, $BeCl_2$, $CO_2$. Угловая форма характерна для частиц, где у центрального атома есть неподеленные электронные пары, например, при $sp^2$-гибридизации (одна неподеленная пара, как в $SO_2$) или $sp^3$-гибридизации (две неподеленные пары, как в $H_2O$).
Ответ: неверно.
в) атомы азота в нитрат-ионе находятся в sp²-гибридном состоянии;
В нитрат-ионе ($NO_3^-$) центральный атом азота ($N$) связан с тремя атомами кислорода ($O$). Азот образует три $\sigma$-связи и не имеет неподеленных электронных пар. Общее число направленных связей и неподеленных пар (стерическое число) равно 3. Это соответствует $sp^2$-гибридизации. Три $sp^2$-гибридные орбитали располагаются в одной плоскости под углами $120°$ друг к другу, что приводит к тригонально-планарной геометрии иона.
Ответ: верно.
г) молекула метана имеет форму тетраэдра, в вершинах которого расположены атомы углерода, а в центре — атом водорода;
Молекула метана ($CH_4$) действительно имеет форму тетраэдра. Однако центральным атомом, расположенным в центре этого тетраэдра, является атом углерода ($C$). Четыре атома водорода ($H$) находятся в вершинах тетраэдра, образуя с углеродом четыре равноценные ковалентные связи. Утверждение неверно описывает расположение атомов в молекуле.
Ответ: неверно.
д) гибридизация атомов, расположенных в третьем периоде и далее, затруднена;
Это утверждение неверно. Атомы элементов третьего периода и последующих периодов (например, $P$, $S$, $Cl$, $As$) активно участвуют в гибридизации. В отличие от элементов второго периода, у них на валентном уровне есть вакантные $d$-орбитали, которые могут участвовать в гибридизации наряду с $s$- и $p$-орбиталями. Это позволяет образовывать большее число связей и объясняет существование таких соединений, как $PCl_5$ ($sp^3d$-гибридизация) и $SF_6$ ($sp^3d^2$-гибридизация). Гибридизация для этих элементов не только не затруднена, но и более разнообразна.
Ответ: неверно.
е) частица, центральный атом которой находится в sp²-гибридном состоянии, имеет форму плоского треугольника;
$sp^2$-гибридизация предполагает наличие трех гибридных орбиталей, лежащих в одной плоскости под углом $120°$. Если все три орбитали участвуют в образовании $\sigma$-связей (частица типа $AX_3$, например, $BF_3$), то молекула действительно имеет форму плоского треугольника. Однако, если одна из гибридных орбиталей занята неподеленной электронной парой (частица типа $AX_2E$, например, $SO_2$), то форма молекулы будет угловой, а не треугольной. Поскольку утверждение не является универсальным для всех случаев $sp^2$-гибридизации, оно считается неверным.
Ответ: неверно.
ж) в молекулах органических соединений атомы углерода могут быть только в sp³-гибридном состоянии;
Это утверждение ложно. Атом углерода в органических соединениях может находиться в трех основных состояниях гибридизации:
- $sp^3$ (в алканах, образует 4 одинарные связи, например, в метане $CH_4$);
- $sp^2$ (в алкенах и аренах, образует двойную связь, например, в этилене $C_2H_4$);
- $sp$ (в алкинах, образует тройную связь, например, в ацетилене $C_2H_2$).
Ответ: неверно.
з) все атомы в молекуле этилена расположены в одной плоскости.
Молекула этилена (этена, $C_2H_4$) состоит из двух атомов углерода, соединенных двойной связью, и четырех атомов водорода. Каждый атом углерода находится в состоянии $sp^2$-гибридизации. Это определяет плоское, тригональное расположение $\sigma$-связей вокруг каждого атома углерода. Двойная связь состоит из одной $\sigma$-связи и одной $\pi$-связи. Образование $\pi$-связи за счет бокового перекрывания негибридизованных $p$-орбиталей требует, чтобы эти орбитали были параллельны. Это жестко фиксирует всю конструкцию, и в результате все шесть атомов молекулы этилена лежат в одной плоскости.
Ответ: верно.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 398 расположенного на странице 61 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №398 (с. 61), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














