Номер 55, страница 17 - гдз по химии 8 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: голубой, зелёный с кристаллами
ISBN: 978-985-599-064-3
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Повторение основных вопросов курса химии VII класса. Количественные понятия в химии. Параграф 5. Молярная масса. Молярный объём - номер 55, страница 17.
№55 (с. 17)
Условие. №55 (с. 17)
скриншот условия
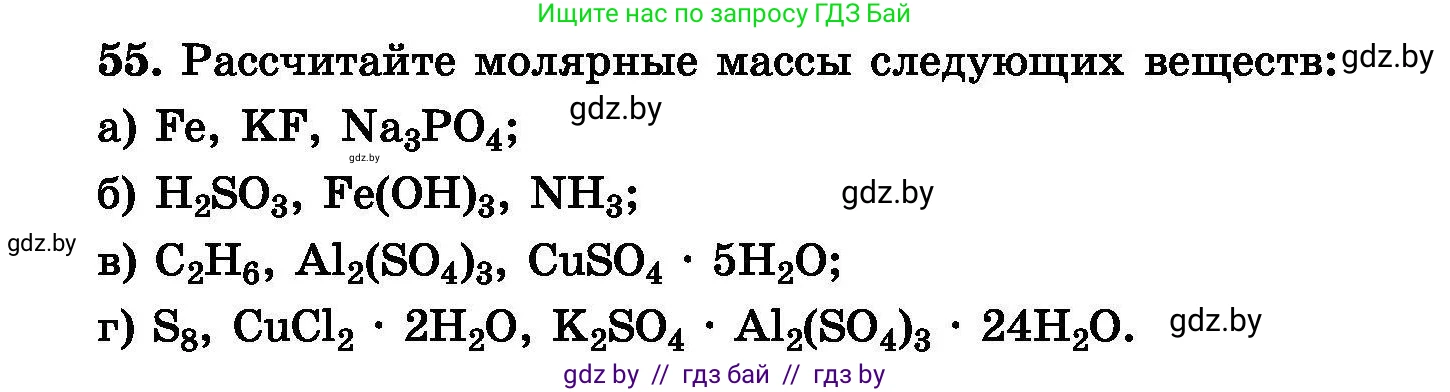
55. Рассчитайте молярные массы следующих веществ:
а) $Fe$, $KF$, $Na_3PO_4$;
б) $H_2SO_3$, $Fe(OH)_3$, $NH_3$;
в) $C_2H_6$, $Al_2(SO_4)_3$, $CuSO_4 \cdot 5H_2O$;
г) $S_8$, $CuCl_2 \cdot 2H_2O$, $K_2SO_4 \cdot Al_2(SO_4)_3 \cdot 24H_2O$.
Решение. №55 (с. 17)

Решение 2. №55 (с. 17)
Для расчета молярной массы ($M$) вещества необходимо сложить молярные массы всех атомов, входящих в его состав, с учетом их количества. Молярная масса элемента численно равна его относительной атомной массе ($A_r$), выраженной в г/моль. Будем использовать следующие округленные значения атомных масс: $A_r(\text{H})=1$; $A_r(\text{C})=12$; $A_r(\text{N})=14$; $A_r(\text{O})=16$; $A_r(\text{F})=19$; $A_r(\text{Na})=23$; $A_r(\text{Al})=27$; $A_r(\text{P})=31$; $A_r(\text{S})=32$; $A_r(\text{Cl})=35.5$; $A_r(\text{K})=39$; $A_r(\text{Fe})=56$; $A_r(\text{Cu})=63.5$.
а) Fe, KF, Na₃PO₄Молярная масса железа (Fe), как простого вещества, равна его атомной массе:
$M(\text{Fe}) = A_r(\text{Fe}) = 56 \text{ г/моль}$.
Молярная масса фторида калия (KF) равна сумме атомных масс калия и фтора:
$M(\text{KF}) = A_r(\text{K}) + A_r(\text{F}) = 39 + 19 = 58 \text{ г/моль}$.
Молярная масса фосфата натрия (Na₃PO₄):
$M(\text{Na}_3\text{PO}_4) = 3 \cdot A_r(\text{Na}) + A_r(\text{P}) + 4 \cdot A_r(\text{O}) = 3 \cdot 23 + 31 + 4 \cdot 16 = 69 + 31 + 64 = 164 \text{ г/моль}$.
Ответ: молярная масса Fe равна 56 г/моль, KF - 58 г/моль, Na₃PO₄ - 164 г/моль.
б) H₂SO₃, Fe(OH)₃, NH₃Молярная масса сернистой кислоты (H₂SO₃):
$M(\text{H}_2\text{SO}_3) = 2 \cdot A_r(\text{H}) + A_r(\text{S}) + 3 \cdot A_r(\text{O}) = 2 \cdot 1 + 32 + 3 \cdot 16 = 2 + 32 + 48 = 82 \text{ г/моль}$.
Молярная масса гидроксида железа(III) (Fe(OH)₃):
$M(\text{Fe(OH)}_3) = A_r(\text{Fe}) + 3 \cdot (A_r(\text{O}) + A_r(\text{H})) = 56 + 3 \cdot (16 + 1) = 56 + 51 = 107 \text{ г/моль}$.
Молярная масса аммиака (NH₃):
$M(\text{NH}_3) = A_r(\text{N}) + 3 \cdot A_r(\text{H}) = 14 + 3 \cdot 1 = 17 \text{ г/моль}$.
Ответ: молярная масса H₂SO₃ равна 82 г/моль, Fe(OH)₃ - 107 г/моль, NH₃ - 17 г/моль.
в) C₂H₆, Al₂(SO₄)₃, CuSO₄ · 5H₂OМолярная масса этана (C₂H₆):
$M(\text{C}_2\text{H}_6) = 2 \cdot A_r(\text{C}) + 6 \cdot A_r(\text{H}) = 2 \cdot 12 + 6 \cdot 1 = 24 + 6 = 30 \text{ г/моль}$.
Молярная масса сульфата алюминия (Al₂(SO₄)₃):
$M(\text{Al}_2(\text{SO}_4)_3) = 2 \cdot A_r(\text{Al}) + 3 \cdot (A_r(\text{S}) + 4 \cdot A_r(\text{O})) = 2 \cdot 27 + 3 \cdot (32 + 4 \cdot 16) = 54 + 3 \cdot 96 = 54 + 288 = 342 \text{ г/моль}$.
Молярная масса пентагидрата сульфата меди(II) (CuSO₄ · 5H₂O), или медного купороса, складывается из массы безводной соли и пяти молекул воды:
$M(\text{H}_2\text{O}) = 2 \cdot 1 + 16 = 18 \text{ г/моль}$.
$M(\text{CuSO}_4 \cdot 5\text{H}_2\text{O}) = (A_r(\text{Cu}) + A_r(\text{S}) + 4 \cdot A_r(\text{O})) + 5 \cdot M(\text{H}_2\text{O}) = (63.5 + 32 + 4 \cdot 16) + 5 \cdot 18 = 159.5 + 90 = 249.5 \text{ г/моль}$.
Ответ: молярная масса C₂H₆ равна 30 г/моль, Al₂(SO₄)₃ - 342 г/моль, CuSO₄ · 5H₂O - 249.5 г/моль.
г) S₈, CuCl₂ · 2H₂O, K₂SO₄ · Al₂(SO₄)₃ · 24H₂OМолярная масса ромбической серы (S₈), состоящей из восьми атомов серы:
$M(\text{S}_8) = 8 \cdot A_r(\text{S}) = 8 \cdot 32 = 256 \text{ г/моль}$.
Молярная масса дигидрата хлорида меди(II) (CuCl₂ · 2H₂O):
$M(\text{CuCl}_2 \cdot 2\text{H}_2\text{O}) = (A_r(\text{Cu}) + 2 \cdot A_r(\text{Cl})) + 2 \cdot M(\text{H}_2\text{O}) = (63.5 + 2 \cdot 35.5) + 2 \cdot 18 = 134.5 + 36 = 170.5 \text{ г/моль}$.
Молярная масса алюмокалиевых квасцов (K₂SO₄ · Al₂(SO₄)₃ · 24H₂O) складывается из масс сульфата калия, сульфата алюминия и 24 молекул воды:
$M(\text{K}_2\text{SO}_4) = 2 \cdot 39 + 32 + 4 \cdot 16 = 174 \text{ г/моль}$.
$M(\text{Al}_2(\text{SO}_4)_3) = 342 \text{ г/моль}$ (рассчитано в пункте в).
$M(24\text{H}_2\text{O}) = 24 \cdot 18 = 432 \text{ г/моль}$.
$M(\text{K}_2\text{SO}_4 \cdot \text{Al}_2(\text{SO}_4)_3 \cdot 24\text{H}_2\text{O}) = 174 + 342 + 432 = 948 \text{ г/моль}$.
Ответ: молярная масса S₈ равна 256 г/моль, CuCl₂ · 2H₂O - 170.5 г/моль, K₂SO₄ · Al₂(SO₄)₃ · 24H₂O - 948 г/моль.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 55 расположенного на странице 17 к сборнику задач 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №55 (с. 17), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.













