Номер 111, страница 31 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 7. Электролиты и неэлектролиты - номер 111, страница 31.
№111 (с. 31)
Условие. №111 (с. 31)
скриншот условия

111. Рассчитайте массовую долю соли в растворе, полученном в результате растворения сульфата калия химическим количеством 1,50 моль в воде массой 3,50 кг.
Решение. №111 (с. 31)

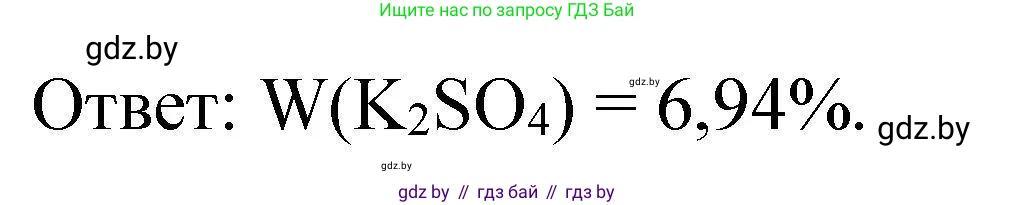
Решение 2. №111 (с. 31)
Дано:
Химическое количество сульфата калия: $n(\text{K}_2\text{SO}_4) = 1.50 \text{ моль}$
Масса воды: $m(\text{H}_2\text{O}) = 3.50 \text{ кг}$
$m(\text{H}_2\text{O}) = 3.50 \text{ кг} = 3500 \text{ г}$
Найти:
Массовую долю сульфата калия в растворе $ω(\text{K}_2\text{SO}_4)$.
Решение:
Массовая доля растворенного вещества в растворе — это отношение массы этого вещества к общей массе раствора. Формула для расчета массовой доли ($ω$):
$ω(\text{вещества}) = \frac{m(\text{вещества})}{m(\text{раствора})}$
Масса раствора ($m(\text{раствора})$) складывается из массы растворенного вещества (сульфата калия, $K_2SO_4$) и массы растворителя (воды, $H_2O$):
$m(\text{раствора}) = m(\text{K}_2\text{SO}_4) + m(\text{H}_2\text{O})$
Сначала вычислим массу сульфата калия, зная его химическое количество и молярную массу. Молярная масса $M(\text{K}_2\text{SO}_4)$ рассчитывается на основе атомных масс элементов (K, S, O) из Периодической таблицы. Используем округленные значения: $A_r(\text{K}) = 39$, $A_r(\text{S}) = 32$, $A_r(\text{O}) = 16$.
$M(\text{K}_2\text{SO}_4) = 2 \cdot A_r(\text{K}) + A_r(\text{S}) + 4 \cdot A_r(\text{O}) = 2 \cdot 39 + 32 + 4 \cdot 16 = 174 \text{ г/моль}$
Теперь находим массу сульфата калия:
$m(\text{K}_2\text{SO}_4) = n(\text{K}_2\text{SO}_4) \cdot M(\text{K}_2\text{SO}_4) = 1.50 \text{ моль} \cdot 174 \text{ г/моль} = 261 \text{ г}$
Далее вычислим общую массу раствора:
$m(\text{раствора}) = m(\text{K}_2\text{SO}_4) + m(\text{H}_2\text{O}) = 261 \text{ г} + 3500 \text{ г} = 3761 \text{ г}$
Наконец, рассчитаем массовую долю сульфата калия. Результат принято выражать в процентах, для чего его умножают на 100%.
$ω(\text{K}_2\text{SO}_4) = \frac{m(\text{K}_2\text{SO}_4)}{m(\text{раствора})} \cdot 100\% = \frac{261 \text{ г}}{3761 \text{ г}} \cdot 100\% \approx 6.9396...\%$
С учетом того, что исходные данные имеют по три значащие цифры, округляем ответ до трех значащих цифр.
$ω(\text{K}_2\text{SO}_4) \approx 6.94\%$
Ответ: массовая доля сульфата калия в растворе составляет 6,94%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 111 расположенного на странице 31 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №111 (с. 31), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














