Номер 150, страница 38 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 10. Сильные и слабые электролиты - номер 150, страница 38.
№150 (с. 38)
Условие. №150 (с. 38)
скриншот условия

150. Запишите формулы указанных веществ и определите, сильным или слабым электролитом является каждое из них в водном растворе. Для каждого вещества составьте уравнения электролитической диссоциации в водном растворе:
а) сульфат натрия, угольная кислота;
б) нитрат железа(III), азотистая кислота;
в) гидроксид лития, сероводородная кислота;
г) фосфорная кислота, хлорид кальция;
д) карбонат калия, фтороводородная кислота.
Решение. №150 (с. 38)

Решение 2. №150 (с. 38)
а) сульфат натрия, угольная кислота
Сульфат натрия имеет формулу $Na_2SO_4$. Это соль, образованная сильным основанием ($NaOH$) и сильной кислотой ($H_2SO_4$). Все растворимые соли являются сильными электролитами. В водном растворе сульфат натрия диссоциирует полностью (необратимо) на ионы:
$Na_2SO_4 \rightarrow 2Na^+ + SO_4^{2-}$
Угольная кислота имеет формулу $H_2CO_3$. Это слабая двухосновная кислота, является слабым электролитом. Ее диссоциация в водном растворе протекает обратимо и ступенчато:
I ступень: $H_2CO_3 \rightleftharpoons H^+ + HCO_3^-$
II ступень: $HCO_3^- \rightleftharpoons H^+ + CO_3^{2-}$
Ответ: Сульфат натрия ($Na_2SO_4$) – сильный электролит, уравнение диссоциации: $Na_2SO_4 \rightarrow 2Na^+ + SO_4^{2-}$. Угольная кислота ($H_2CO_3$) – слабый электролит, диссоциирует ступенчато: $H_2CO_3 \rightleftharpoons H^+ + HCO_3^-$; $HCO_3^- \rightleftharpoons H^+ + CO_3^{2-}$.
б) нитрат железа(III), азотистая кислота
Нитрат железа(III) имеет формулу $Fe(NO_3)_3$. Это растворимая соль, является сильным электролитом. В водном растворе диссоциирует полностью на ионы:
$Fe(NO_3)_3 \rightarrow Fe^{3+} + 3NO_3^-$
Азотистая кислота имеет формулу $HNO_2$. Это слабая одноосновная кислота, является слабым электролитом. Диссоциация протекает обратимо:
$HNO_2 \rightleftharpoons H^+ + NO_2^-$
Ответ: Нитрат железа(III) ($Fe(NO_3)_3$) – сильный электролит, уравнение диссоциации: $Fe(NO_3)_3 \rightarrow Fe^{3+} + 3NO_3^-$. Азотистая кислота ($HNO_2$) – слабый электролит, уравнение диссоциации: $HNO_2 \rightleftharpoons H^+ + NO_2^-$.
в) гидроксид лития, сероводородная кислота
Гидроксид лития имеет формулу $LiOH$. Это гидроксид щелочного металла (щёлочь), является сильным основанием и сильным электролитом. В водном растворе диссоциирует полностью:
$LiOH \rightarrow Li^+ + OH^-$
Сероводородная кислота имеет формулу $H_2S$. Это слабая двухосновная кислота, является слабым электролитом. Диссоциация протекает обратимо и ступенчато:
I ступень: $H_2S \rightleftharpoons H^+ + HS^-$
II ступень: $HS^- \rightleftharpoons H^+ + S^{2-}$
Ответ: Гидроксид лития ($LiOH$) – сильный электролит, уравнение диссоциации: $LiOH \rightarrow Li^+ + OH^-$. Сероводородная кислота ($H_2S$) – слабый электролит, диссоциирует ступенчато: $H_2S \rightleftharpoons H^+ + HS^-$; $HS^- \rightleftharpoons H^+ + S^{2-}$.
г) фосфорная кислота, хлорид кальция
Фосфорная кислота имеет формулу $H_3PO_4$. Это трехосновная кислота средней силы, которую относят к слабым электролитам. Диссоциация протекает обратимо и ступенчато:
I ступень: $H_3PO_4 \rightleftharpoons H^+ + H_2PO_4^-$
II ступень: $H_2PO_4^- \rightleftharpoons H^+ + HPO_4^{2-}$
III ступень: $HPO_4^{2-} \rightleftharpoons H^+ + PO_4^{3-}$
Хлорид кальция имеет формулу $CaCl_2$. Это соль, образованная сильным основанием ($Ca(OH)_2$) и сильной кислотой ($HCl$). Является сильным электролитом. В водном растворе диссоциирует полностью:
$CaCl_2 \rightarrow Ca^{2+} + 2Cl^-$
Ответ: Фосфорная кислота ($H_3PO_4$) – слабый электролит, диссоциирует ступенчато: $H_3PO_4 \rightleftharpoons H^+ + H_2PO_4^-$; $H_2PO_4^- \rightleftharpoons H^+ + HPO_4^{2-}$; $HPO_4^{2-} \rightleftharpoons H^+ + PO_4^{3-}$. Хлорид кальция ($CaCl_2$) – сильный электролит, уравнение диссоциации: $CaCl_2 \rightarrow Ca^{2+} + 2Cl^-$.
д) карбонат калия, фтороводородная кислота
Карбонат калия имеет формулу $K_2CO_3$. Это растворимая соль, является сильным электролитом. В водном растворе диссоциирует полностью:
$K_2CO_3 \rightarrow 2K^+ + CO_3^{2-}$
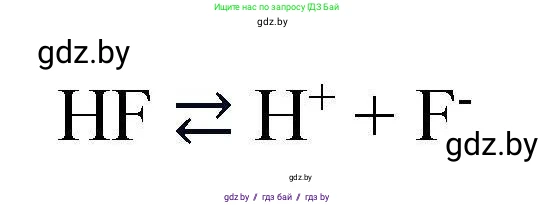
Фтороводородная (плавиковая) кислота имеет формулу $HF$. Несмотря на высокую электроотрицательность фтора, это слабая кислота и слабый электролит. Диссоциация протекает обратимо:
$HF \rightleftharpoons H^+ + F^-$
Ответ: Карбонат калия ($K_2CO_3$) – сильный электролит, уравнение диссоциации: $K_2CO_3 \rightarrow 2K^+ + CO_3^{2-}$. Фтороводородная кислота ($HF$) – слабый электролит, уравнение диссоциации: $HF \rightleftharpoons H^+ + F^-$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 150 расположенного на странице 38 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №150 (с. 38), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














