Номер 403, страница 81 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 24. Аммиак - номер 403, страница 81.
№403 (с. 81)
Условие. №403 (с. 81)
скриншот условия
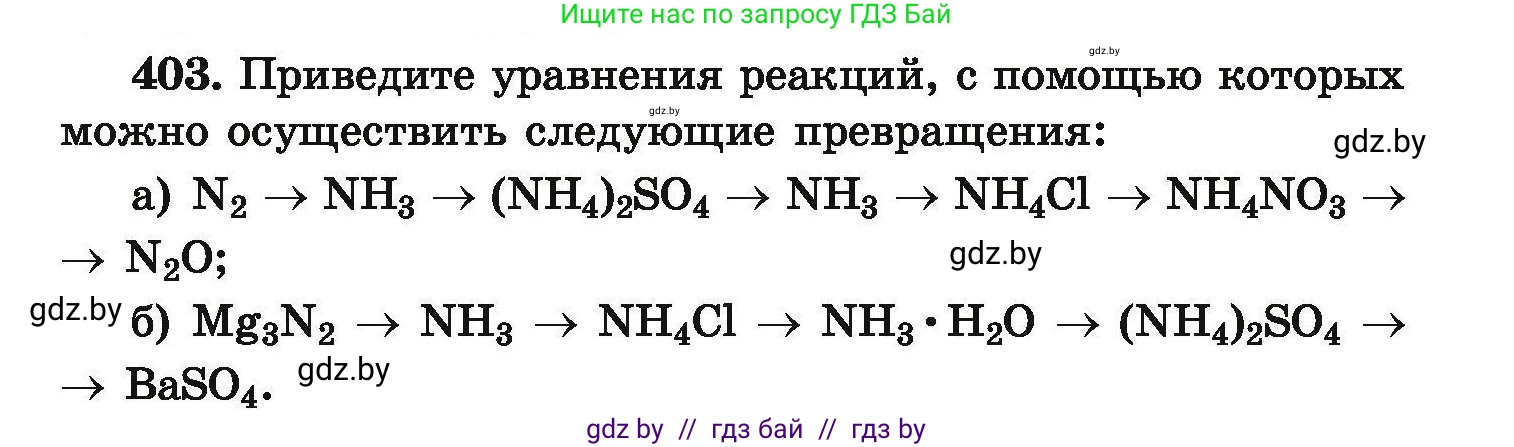
403. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) $N_2 \to NH_3 \to (NH_4)_2SO_4 \to NH_3 \to NH_4Cl \to NH_4NO_3 \to N_2O;$
б) $Mg_3N_2 \to NH_3 \to NH_4Cl \to NH_3 \cdot H_2O \to (NH_4)_2SO_4 \to BaSO_4.$
Решение. №403 (с. 81)

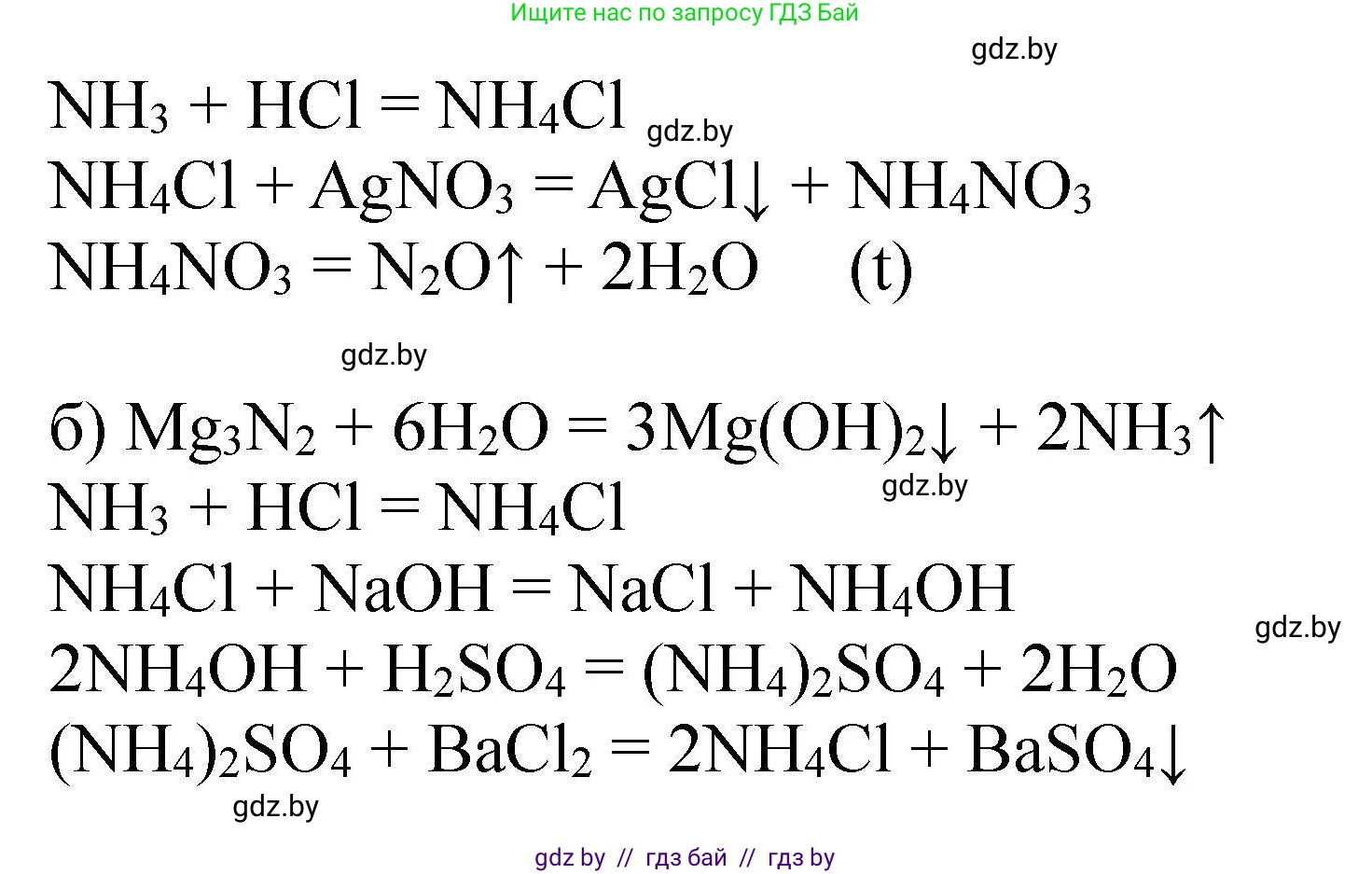
Решение 2. №403 (с. 81)
а) N₂ → NH₃ → (NH₄)₂SO₄ → NH₃ → NH₄Cl → NH₄NO₃ → N₂O
1. Получение аммиака из азота и водорода (промышленный метод, процесс Габера-Боша). Реакция обратима, проводится при высокой температуре, давлении и с использованием катализатора (железа):
$N_2 + 3H_2 \rightleftharpoons 2NH_3$
2. Аммиак проявляет основные свойства и реагирует с кислотами. При взаимодействии с серной кислотой образуется соль — сульфат аммония:
$2NH_3 + H_2SO_4 \rightarrow (NH_4)_2SO_4$
3. Для получения аммиака из его солей необходимо подействовать на них сильным основанием (щелочью), например, гидроксидом натрия, при нагревании:
$(NH_4)_2SO_4 + 2NaOH \xrightarrow{t} Na_2SO_4 + 2NH_3\uparrow + 2H_2O$
4. Аммиак реагирует с соляной кислотой, образуя хлорид аммония. Если реагенты газообразны, образуется белый дым:
$NH_3 + HCl \rightarrow NH_4Cl$
5. Для получения нитрата аммония из хлорида аммония можно провести реакцию ионного обмена с нитратом серебра. В результате выпадает нерастворимый осадок хлорида серебра:
$NH_4Cl + AgNO_3 \rightarrow NH_4NO_3 + AgCl\downarrow$
6. Оксид азота(I), или закись азота, получают термическим разложением нитрата аммония при температуре около 200-250 °C:
$NH_4NO_3 \xrightarrow{t} N_2O\uparrow + 2H_2O$
Ответ:
$N_2 + 3H_2 \rightleftharpoons 2NH_3$
$2NH_3 + H_2SO_4 \rightarrow (NH_4)_2SO_4$
$(NH_4)_2SO_4 + 2NaOH \xrightarrow{t} Na_2SO_4 + 2NH_3\uparrow + 2H_2O$
$NH_3 + HCl \rightarrow NH_4Cl$
$NH_4Cl + AgNO_3 \rightarrow NH_4NO_3 + AgCl\downarrow$
$NH_4NO_3 \xrightarrow{t} N_2O\uparrow + 2H_2O$
б) Mg₃N₂ → NH₃ → NH₄Cl → NH₃·H₂O → (NH₄)₂SO₄ → BaSO₄
1. Нитрид магния, как и другие нитриды активных металлов, подвергается полному гидролизу при взаимодействии с водой с образованием соответствующего гидроксида и аммиака:
$Mg_3N_2 + 6H_2O \rightarrow 3Mg(OH)_2\downarrow + 2NH_3\uparrow$
2. Аммиак реагирует с соляной кислотой с образованием соли — хлорида аммония:
$NH_3 + HCl \rightarrow NH_4Cl$
3. Чтобы получить гидрат аммиака (раствор аммиака в воде) из хлорида аммония, сначала вытесняют аммиак действием щелочи, а затем растворяют полученный газ в воде. Уравнение показывает первую стадию — вытеснение аммиака:
$NH_4Cl + NaOH \rightarrow NaCl + NH_3\uparrow + H_2O$
4. Раствор аммиака (гидрат аммиака) является основанием и реагирует с серной кислотой, образуя сульфат аммония и воду:
$2(NH_3 \cdot H_2O) + H_2SO_4 \rightarrow (NH_4)_2SO_4 + 2H_2O$
5. Для получения сульфата бария из сульфата аммония необходимо провести качественную реакцию на сульфат-ион, добавив растворимую соль бария, например, хлорид бария. Сульфат бария выпадает в виде белого осадка:
$(NH_4)_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NH_4Cl$
Ответ:
$Mg_3N_2 + 6H_2O \rightarrow 3Mg(OH)_2\downarrow + 2NH_3\uparrow$
$NH_3 + HCl \rightarrow NH_4Cl$
$NH_4Cl + NaOH \rightarrow NaCl + NH_3\uparrow + H_2O$
$2(NH_3 \cdot H_2O) + H_2SO_4 \rightarrow (NH_4)_2SO_4 + 2H_2O$
$(NH_4)_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NH_4Cl$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 403 расположенного на странице 81 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №403 (с. 81), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














