Номер 473, страница 92 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 29. Минеральные удобрения - номер 473, страница 92.
№473 (с. 92)
Условие. №473 (с. 92)
скриншот условия

473. Рассчитайте массовую долю:
а) азота в аммиачной селитре;
б) калия в сильвините;
в) азота в мочевине;
г) азота в кальциевой селитре;
д) азота в сульфате аммония;
е) калия в калийной селитре.
Решение. №473 (с. 92)

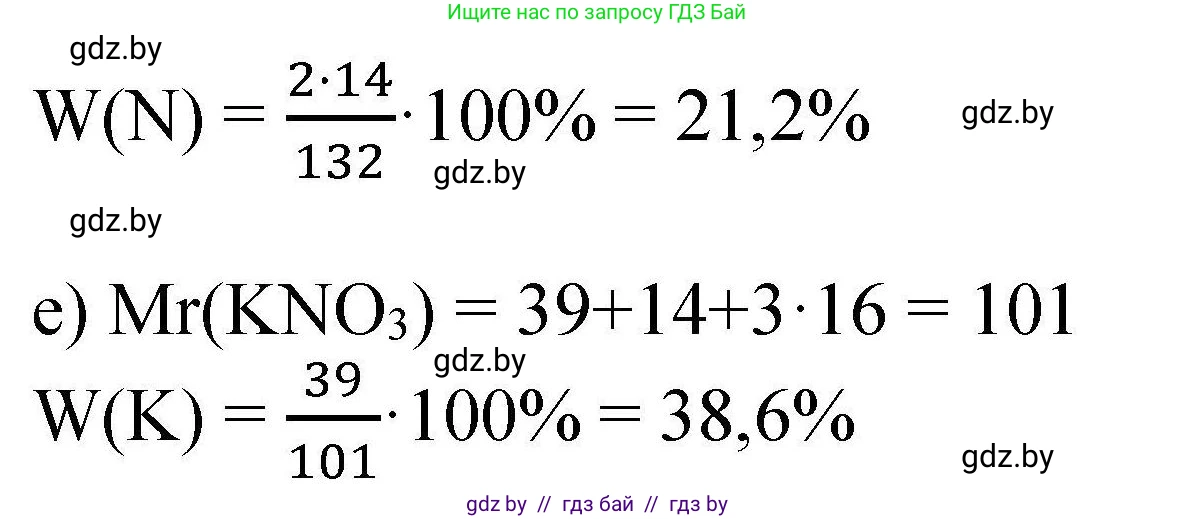
Решение 2. №473 (с. 92)
Дано:
Относительные атомные массы элементов (округленные):
$Ar(N) = 14$ а.е.м. (азот)
$Ar(H) = 1$ а.е.м. (водород)
$Ar(O) = 16$ а.е.м. (кислород)
$Ar(K) = 39$ а.е.м. (калий)
$Ar(Cl) = 35.5$ а.е.м. (хлор)
$Ar(C) = 12$ а.е.м. (углерод)
$Ar(Ca) = 40$ а.е.м. (кальций)
$Ar(S) = 32$ а.е.м. (сера)
Найти:
а) $ω(N)$ в аммиачной селитре
б) $ω(K)$ в сильвините
в) $ω(N)$ в мочевине
г) $ω(N)$ в кальциевой селитре
д) $ω(N)$ в сульфате аммония
е) $ω(K)$ в калийной селитре
Решение:
Массовая доля элемента в сложном веществе ($ω$) вычисляется как отношение массы всех атомов этого элемента в молекуле к относительной молекулярной массе всего вещества, выраженное в долях единицы или процентах.
Формула для расчета:
$ω(элемента) = \frac{n \cdot Ar(элемента)}{Mr(вещества)} \cdot 100\%$
где $n$ — количество атомов элемента в формульной единице, $Ar$ — относительная атомная масса элемента, а $Mr$ — относительная молекулярная (или формульная) масса вещества.
а) азота в аммиачной селитре;
Химическая формула аммиачной селитры (нитрата аммония) — $NH_4NO_3$. Сначала рассчитаем её относительную молекулярную массу: $Mr(NH_4NO_3) = Ar(N) + 4 \cdot Ar(H) + Ar(N) + 3 \cdot Ar(O) = 2 \cdot 14 + 4 \cdot 1 + 3 \cdot 16 = 28 + 4 + 48 = 80$. В одной формульной единице содержится 2 атома азота. Теперь можем рассчитать массовую долю азота: $ω(N) = \frac{2 \cdot Ar(N)}{Mr(NH_4NO_3)} \cdot 100\% = \frac{2 \cdot 14}{80} \cdot 100\% = \frac{28}{80} \cdot 100\% = 0.35 \cdot 100\% = 35\%$.
Ответ: 35%.
б) калия в сильвините;
Сильвинит — это минерал, основным калийсодержащим компонентом которого является сильвин (хлорид калия). Расчет проведем для химически чистого хлорида калия ($KCl$). Его относительная формульная масса: $Mr(KCl) = Ar(K) + Ar(Cl) = 39 + 35.5 = 74.5$. В одной формульной единице содержится 1 атом калия. Массовая доля калия: $ω(K) = \frac{1 \cdot Ar(K)}{Mr(KCl)} \cdot 100\% = \frac{39}{74.5} \cdot 100\% \approx 52.35\%$. Округляя до десятых, получаем 52.4%.
Ответ: 52.4%.
в) азота в мочевине;
Химическая формула мочевины (карбамида) — $CO(NH_2)_2$. Рассчитаем её относительную молекулярную массу: $Mr(CO(NH_2)_2) = Ar(C) + Ar(O) + 2 \cdot Ar(N) + 4 \cdot Ar(H) = 12 + 16 + 2 \cdot 14 + 4 \cdot 1 = 60$. В одной молекуле содержится 2 атома азота. Массовая доля азота: $ω(N) = \frac{2 \cdot Ar(N)}{Mr(CO(NH_2)_2)} \cdot 100\% = \frac{2 \cdot 14}{60} \cdot 100\% = \frac{28}{60} \cdot 100\% \approx 46.67\%$. Округляя до десятых, получаем 46.7%.
Ответ: 46.7%.
г) азота в кальциевой селитре;
Химическая формула кальциевой селитры (нитрата кальция) — $Ca(NO_3)_2$. Рассчитаем её относительную формульную массу: $Mr(Ca(NO_3)_2) = Ar(Ca) + 2 \cdot (Ar(N) + 3 \cdot Ar(O)) = 40 + 2 \cdot (14 + 3 \cdot 16) = 40 + 2 \cdot 62 = 164$. В одной формульной единице содержится 2 атома азота. Массовая доля азота: $ω(N) = \frac{2 \cdot Ar(N)}{Mr(Ca(NO_3)_2)} \cdot 100\% = \frac{2 \cdot 14}{164} \cdot 100\% = \frac{28}{164} \cdot 100\% \approx 17.07\%$. Округляя до десятых, получаем 17.1%.
Ответ: 17.1%.
д) азота в сульфате аммония;
Химическая формула сульфата аммония — $(NH_4)_2SO_4$. Рассчитаем его относительную формульную массу: $Mr((NH_4)_2SO_4) = 2 \cdot (Ar(N) + 4 \cdot Ar(H)) + Ar(S) + 4 \cdot Ar(O) = 2 \cdot (14 + 4) + 32 + 4 \cdot 16 = 2 \cdot 18 + 32 + 64 = 36 + 32 + 64 = 132$. В одной формульной единице содержится 2 атома азота. Массовая доля азота: $ω(N) = \frac{2 \cdot Ar(N)}{Mr((NH_4)_2SO_4)} \cdot 100\% = \frac{2 \cdot 14}{132} \cdot 100\% = \frac{28}{132} \cdot 100\% \approx 21.21\%$. Округляя до десятых, получаем 21.2%.
Ответ: 21.2%.
е) калия в калийной селитре.
Химическая формула калийной селитры (нитрата калия) — $KNO_3$. Рассчитаем её относительную формульную массу: $Mr(KNO_3) = Ar(K) + Ar(N) + 3 \cdot Ar(O) = 39 + 14 + 3 \cdot 16 = 39 + 14 + 48 = 101$. В одной формульной единице содержится 1 атом калия. Массовая доля калия: $ω(K) = \frac{1 \cdot Ar(K)}{Mr(KNO_3)} \cdot 100\% = \frac{39}{101} \cdot 100\% \approx 38.61\%$. Округляя до десятых, получаем 38.6%.
Ответ: 38.6%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 473 расположенного на странице 92 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №473 (с. 92), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














