Номер 614, страница 111 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 38. Строительные материалы на основе природных оксидов и солей - номер 614, страница 111.
№614 (с. 111)
Условие. №614 (с. 111)
скриншот условия

614. Негашёную известь какой массой можно получить из мела массой 240 кг, в котором массовая доля $CaCO_3$ равна $95,0\%$?
Решение. №614 (с. 111)
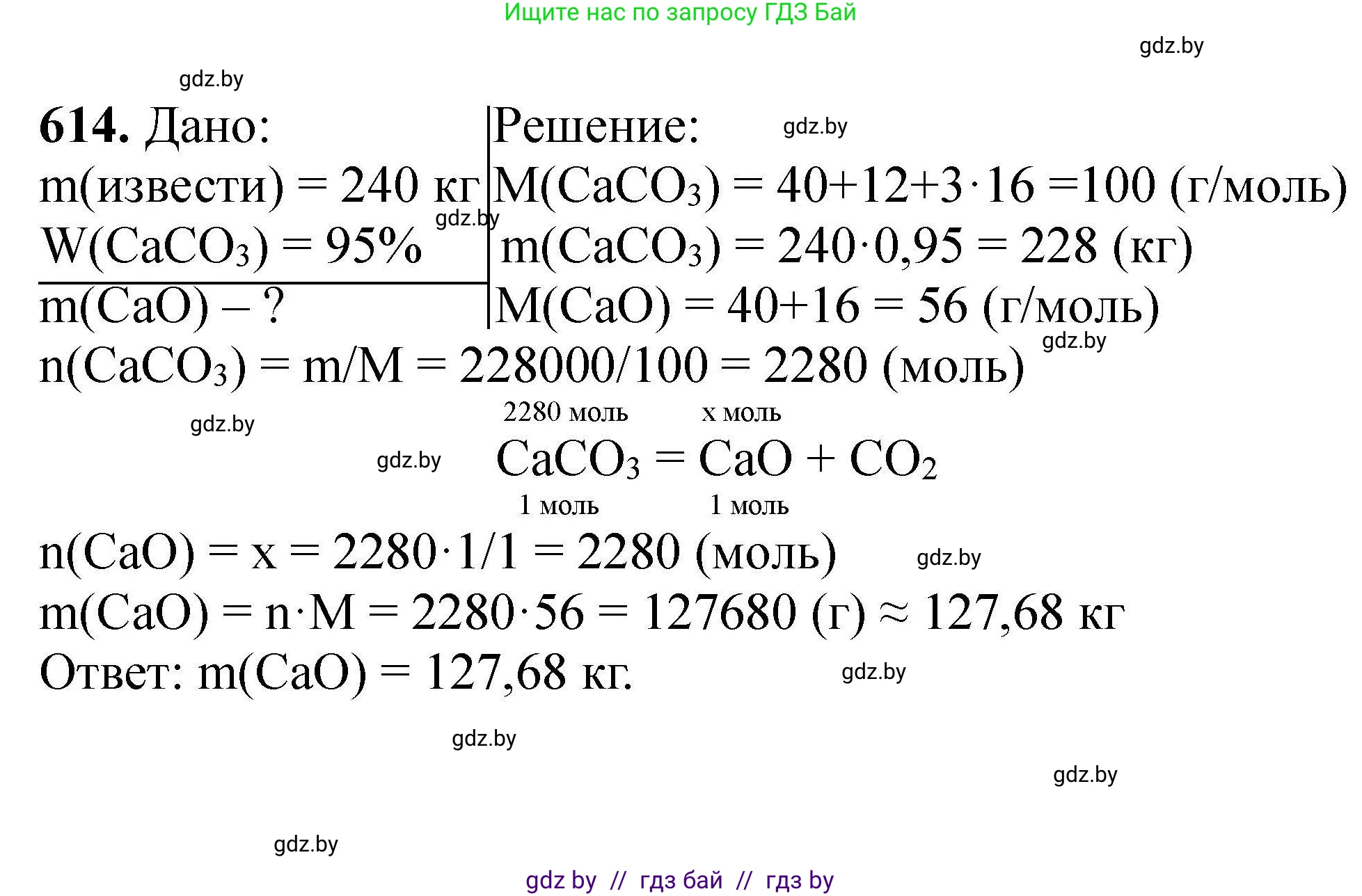
Решение 2. №614 (с. 111)
Дано:
$m(\text{мела}) = 240 \text{ кг}$
$\omega(\text{CaCO}_3) = 95,0 \% = 0,95$
Найти:
$m(\text{CaO}) - ?$
Решение:
1. Процесс получения негашёной извести (оксида кальция, $CaO$) из мела (основной компонент - карбонат кальция, $CaCO_3$) описывается уравнением реакции термического разложения:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
2. Поскольку мел содержит примеси, сначала необходимо рассчитать массу чистого карбоната кальция, который будет участвовать в реакции.
$m(\text{CaCO}_3) = m(\text{мела}) \cdot \omega(\text{CaCO}_3) = 240 \text{ кг} \cdot 0,95 = 228 \text{ кг}$
3. Теперь вычислим молярные массы участвующих в расчете веществ. Для удобства будем использовать киломоли (кмоль) и килограммы (кг), так как исходные данные представлены в килограммах.
Молярная масса карбоната кальция:
$M(\text{CaCO}_3) = M(Ca) + M(C) + 3 \cdot M(O) = 40 + 12 + 3 \cdot 16 = 100 \text{ г/моль} = 100 \text{ кг/кмоль}$
Молярная масса оксида кальция (негашёной извести):
$M(\text{CaO}) = M(Ca) + M(O) = 40 + 16 = 56 \text{ г/моль} = 56 \text{ кг/кмоль}$
4. Рассчитаем количество вещества (в киломолях) карбоната кальция.
$n(\text{CaCO}_3) = \frac{m(\text{CaCO}_3)}{M(\text{CaCO}_3)} = \frac{228 \text{ кг}}{100 \text{ кг/кмоль}} = 2,28 \text{ кмоль}$
5. Согласно стехиометрическим коэффициентам в уравнении реакции, из одного моля карбоната кальция образуется один моль оксида кальция. Следовательно, их количества веществ равны:
$n(\text{CaO}) = n(\text{CaCO}_3) = 2,28 \text{ кмоль}$
6. Наконец, рассчитаем массу негашёной извести, которая может быть получена.
$m(\text{CaO}) = n(\text{CaO}) \cdot M(\text{CaO}) = 2,28 \text{ кмоль} \cdot 56 \text{ кг/кмоль} = 127,68 \text{ кг}$
Поскольку исходные данные (240 кг и 95,0 %) представлены с тремя значащими цифрами, результат следует округлить до трех значащих цифр.
$m(\text{CaO}) \approx 128 \text{ кг}$
Ответ: из 240 кг мела можно получить 128 кг негашёной извести.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 614 расположенного на странице 111 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №614 (с. 111), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














