Номер 80, страница 22 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава I. Повторение основных вопросов курса химии VIII класса. Параграф 5. Примеры расчётов по уравнениям окислительно восстановительных реакций - номер 80, страница 22.
№80 (с. 22)
Условие. №80 (с. 22)
скриншот условия

80. Образец оксида меди(II) массой 16,0 г частично восстановили водородом при высокой температуре. После реакции суммарная масса полученного твёрдого остатка, состоящего из меди и оксида меди(II), составила 14,4 г. Определите массовую долю оксида меди в полученном твёрдом остатке.
Решение. №80 (с. 22)

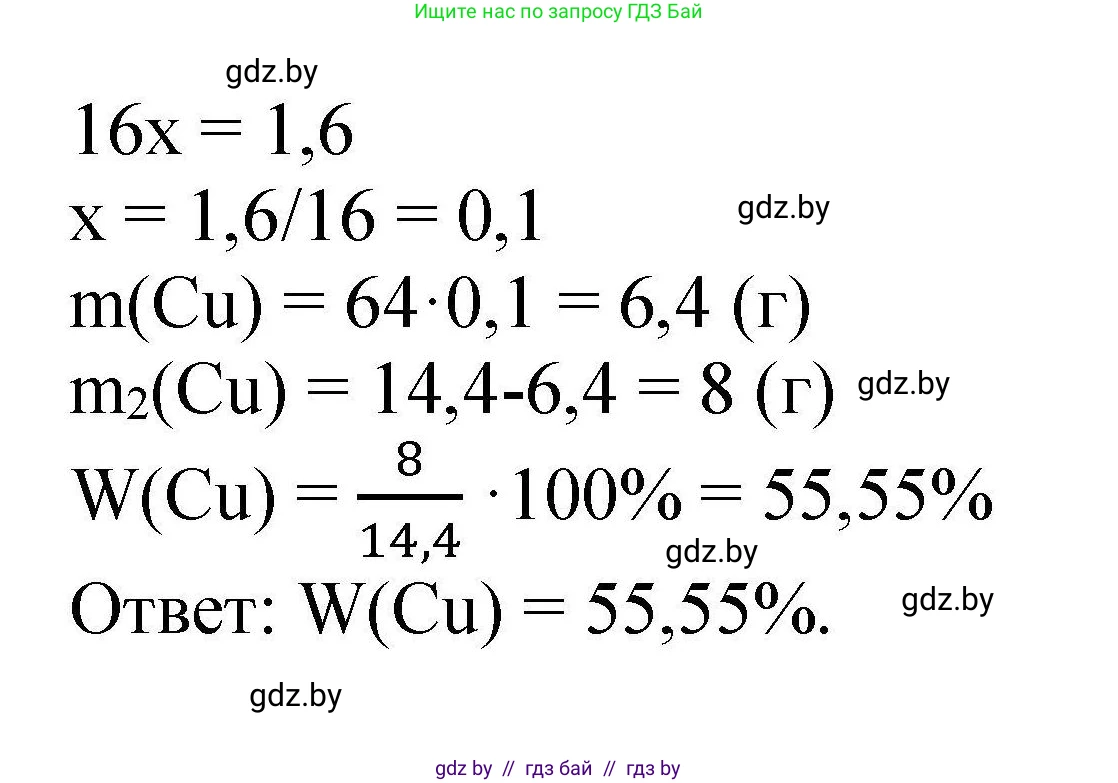
Решение 2. №80 (с. 22)
Дано:
$m_{\text{исх}}(\text{CuO}) = 16,0 \text{ г}$
$m_{\text{остатка}} = 14,4 \text{ г}$
Найти:
$\omega(\text{CuO в остатке}) - ?$
Решение:
1. Запишем уравнение реакции восстановления оксида меди(II) водородом:
$\text{CuO} + \text{H}_2 \xrightarrow{t} \text{Cu} + \text{H}_2\text{O}$
Твёрдый остаток после реакции представляет собой смесь непрореагировавшего оксида меди(II) и образовавшейся металлической меди.
2. Уменьшение массы твёрдого вещества произошло за счёт того, что кислород из состава оксида меди(II) соединился с водородом и улетучился в виде паров воды. Найдем массу кислорода, который вступил в реакцию:
$m(\text{O}) = m_{\text{исх}}(\text{CuO}) - m_{\text{остатка}} = 16,0 \text{ г} - 14,4 \text{ г} = 1,6 \text{ г}$
3. Рассчитаем молярные массы веществ, используя периодическую таблицу химических элементов:
$M(\text{O}) = 16 \text{ г/моль}$
$M(\text{Cu}) = 64 \text{ г/моль}$
$M(\text{CuO}) = M(\text{Cu}) + M(\text{O}) = 64 + 16 = 80 \text{ г/моль}$
4. Найдем количество вещества (число моль) прореагировавшего кислорода:
$n(\text{O}) = \frac{m(\text{O})}{M(\text{O})} = \frac{1,6 \text{ г}}{16 \text{ г/моль}} = 0,1 \text{ моль}$
5. Согласно уравнению реакции, в 1 моль $\text{CuO}$ содержится 1 моль атомов кислорода. Следовательно, количество вещества прореагировавшего оксида меди(II) равно количеству вещества прореагировавшего кислорода:
$n_{\text{прореаг}}(\text{CuO}) = n(\text{O}) = 0,1 \text{ моль}$
6. Теперь можно найти массу оксида меди(II), который вступил в реакцию:
$m_{\text{прореаг}}(\text{CuO}) = n_{\text{прореаг}}(\text{CuO}) \cdot M(\text{CuO}) = 0,1 \text{ моль} \cdot 80 \text{ г/моль} = 8,0 \text{ г}$
7. Зная исходную массу оксида меди(II) и массу прореагировавшего оксида, найдем массу оксида меди(II), оставшегося в твердом остатке:
$m_{\text{ост}}(\text{CuO}) = m_{\text{исх}}(\text{CuO}) - m_{\text{прореаг}}(\text{CuO}) = 16,0 \text{ г} - 8,0 \text{ г} = 8,0 \text{ г}$
8. Наконец, определим массовую долю оксида меди(II) в полученном твердом остатке, масса которого по условию равна 14,4 г:
$\omega(\text{CuO в остатке}) = \frac{m_{\text{ост}}(\text{CuO})}{m_{\text{остатка}}} \cdot 100\% = \frac{8,0 \text{ г}}{14,4 \text{ г}} \cdot 100\% \approx 55,56\%$
Ответ: массовая доля оксида меди в полученном твёрдом остатке составляет 55,56%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 80 расположенного на странице 22 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №80 (с. 22), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














