Номер 104, страница 37 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 2. Углеводороды. 2.1. Алканы - номер 104, страница 37.
№104 (с. 37)
Условие. №104 (с. 37)
скриншот условия
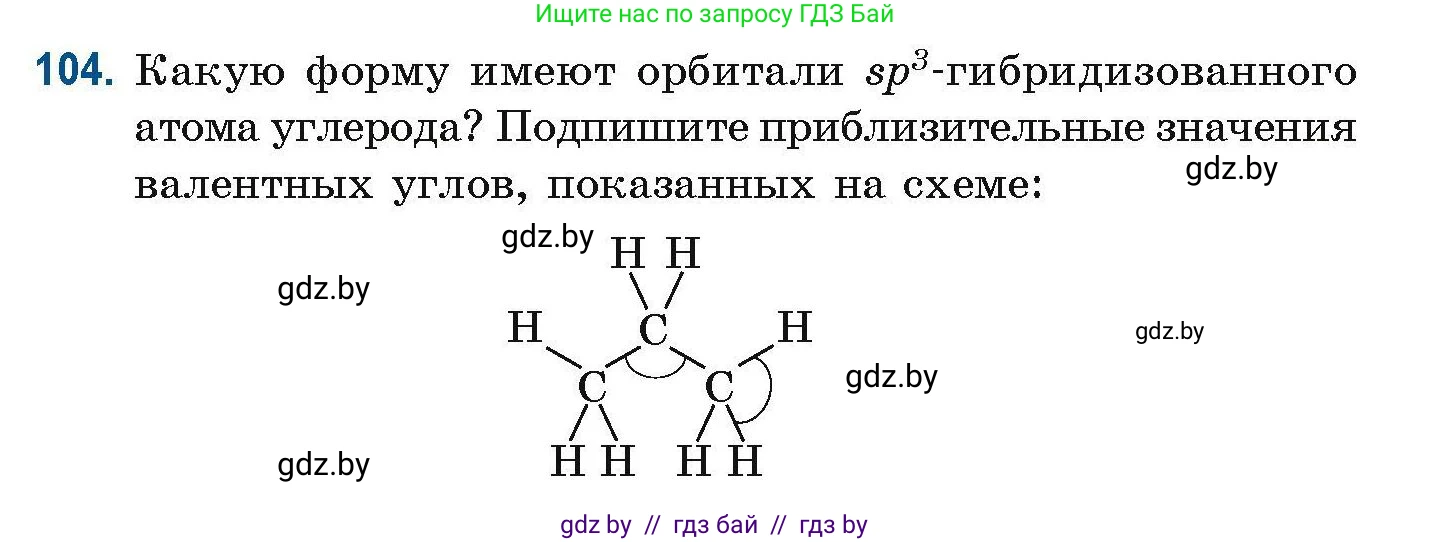
104. Какую форму имеют орбитали $sp^3$-гибридизованного атома углерода? Подпишите приблизительные значения валентных углов, показанных на схеме:
$\begin{array}{ccccccc}& {H} & & & {H} & & \\& \diagdown & \text{\Large$\curvearrowleft$} & \diagup & & & \\& & {C} & & & & \\\diagdown & & \text{\Large$\curvearrowleft$} & & \diagdown & & \\{H} \text{--} & {C} & & & {C} & \text{--}{H} & \text{\Large$\curvearrowleft$} \\& \diagdown \diagup & & & \diagdown \diagup & & \\& {H} \quad {H} & & & {H} \quad {H} & &\end{array}$
Решение. №104 (с. 37)
Решение 2. №104 (с. 37)
Какую форму имеют орбитали sp³-гибридизованного атома углерода?
Атом углерода в состоянии sp³-гибридизации имеет четыре одинаковые по форме и энергии гибридные орбитали. Эти орбитали возникают в результате смешения одной s-орбитали и трех p-орбиталей. Согласно теории отталкивания электронных пар валентной оболочки (VSEPR), для минимизации взаимного отталкивания эти четыре орбитали располагаются в пространстве таким образом, что их оси направлены к вершинам правильного тетраэдра. Атом углерода при этом находится в центре этого тетраэдра. Угол между любыми двумя sp³-гибридными орбиталями составляет $109.5^\circ$ или $109^\circ28'$.
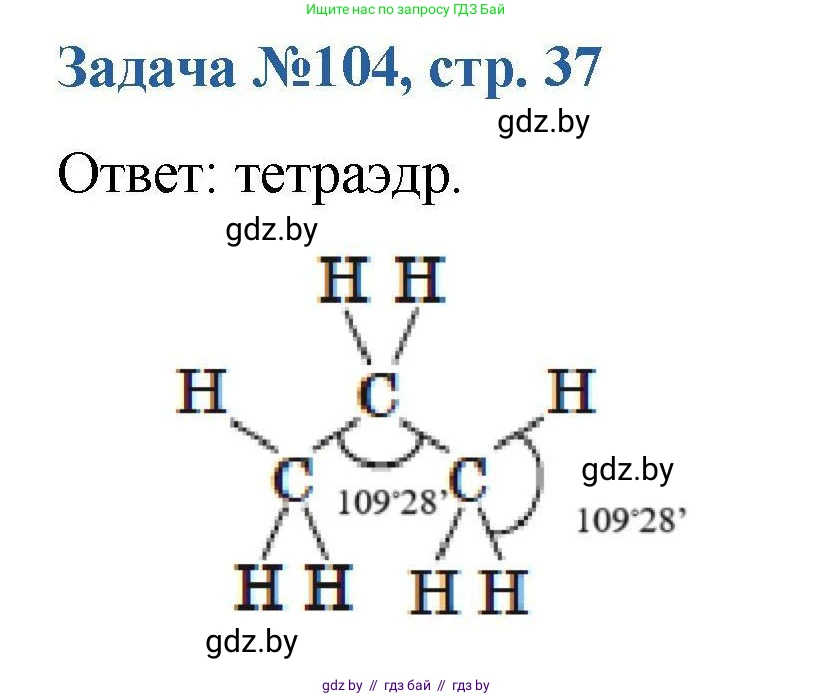
Ответ: Орбитали sp³-гибридизованного атома углерода имеют тетраэдрическую форму.
Подпишите приблизительные значения валентных углов, показанных на схеме:
На схеме изображена структурная формула молекулы пропана ($C_3H_8$). В этой молекуле все три атома углерода образуют только одинарные (сигма-) связи, а значит, каждый из них находится в состоянии sp³-гибридизации. Следовательно, геометрия связей вокруг каждого атома углерода близка к тетраэдрической.
Угол, обозначенный слева, представляет собой валентный угол C−C−C. Угол, обозначенный справа, — это валентный угол H−C−H в одной из концевых метильных групп. Для идеальной тетраэдрической геометрии оба эти угла должны быть равны $109.5^\circ$. В реальной молекуле могут быть небольшие отклонения из-за стерических факторов (например, угол C−C−C в пропане составляет около $112^\circ$), но в качестве приблизительного значения принято использовать идеальный тетраэдрический угол.
Ответ: Оба указанных на схеме валентных угла приблизительно равны $109.5^\circ$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 104 расположенного на странице 37 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №104 (с. 37), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














