Номер 43, страница 20 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 1. Введение в органическую химию. 1.1. Задачи для повторения - номер 43, страница 20.
№43 (с. 20)
Условие. №43 (с. 20)
скриншот условия
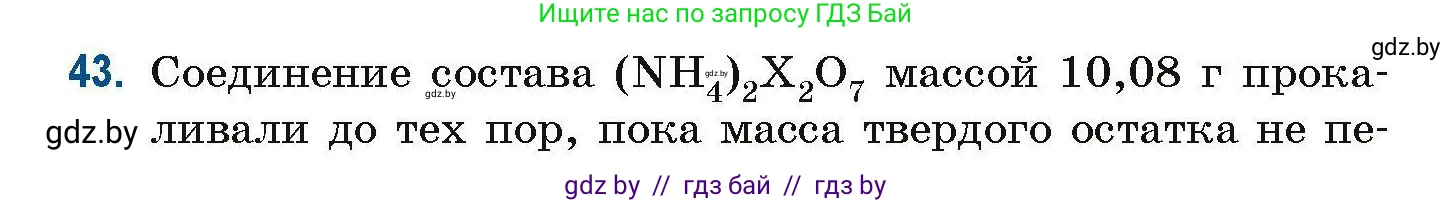

43. Соединение состава $(NH_4)_2X_2O_7$ массой 10,08 г прокаливали до тех пор, пока масса твердого остатка не перестала изменяться. В результате образовалось 6,08 г оксида элемента X, степень окисления элемента X в котором равна +3. Установите элемент X.
Решение. №43 (с. 20)

Решение 2. №43 (с. 20)
Дано:
Формула соединения: $(NH_4)_2X_2O_7$
Масса $(NH_4)_2X_2O_7$: $m_{исх} = 10,08 \text{ г}$
Масса твердого остатка (оксида элемента X): $m_{ост} = 6,08 \text{ г}$
Степень окисления X в оксиде: $+3$
Найти:
Элемент X - ?
Решение:
1. Составим уравнение реакции. При прокаливании соединение $(NH_4)_2X_2O_7$ разлагается. Твердым остатком является оксид элемента X, в котором его степень окисления равна $+3$. Формула такого оксида — $X_2O_3$. Так как исходное соединение является солью аммония, содержащей анион-окислитель (степень окисления азота в $NH_4^+$ равна -3, а степень окисления X в $X_2O_7^{2-}$ должна быть +6), при разложении выделяются газообразные продукты, такие как азот $N_2$ и вода $H_2O$.
Запишем уравнение реакции разложения:
$(NH_4)_2X_2O_7 \xrightarrow{t} X_2O_3 + N_2 \uparrow + 4H_2O \uparrow$
Проверим баланс атомов в уравнении:
N: слева 2, справа 2
H: слева $2 \times 4 = 8$, справа $4 \times 2 = 8$
X: слева 2, справа 2
O: слева 7, справа $3 + 4 \times 1 = 7$
Уравнение составлено верно.
2. Определим молярную массу элемента X. Пусть $M(X)$ - молярная масса элемента X в г/моль. Выразим молярные массы исходного вещества и продукта через $M(X)$:
Молярная масса исходного соединения $(NH_4)_2X_2O_7$:
$M((NH_4)_2X_2O_7) = 2 \cdot M(N) + 8 \cdot M(H) + 2 \cdot M(X) + 7 \cdot M(O) = 2 \cdot 14 + 8 \cdot 1 + 2 \cdot M(X) + 7 \cdot 16 = 28 + 8 + 2M(X) + 112 = (148 + 2M(X)) \text{ г/моль}$
Молярная масса оксида $X_2O_3$:
$M(X_2O_3) = 2 \cdot M(X) + 3 \cdot M(O) = 2 \cdot M(X) + 3 \cdot 16 = (2M(X) + 48) \text{ г/моль}$
3. Составим пропорцию на основе уравнения реакции. Согласно уравнению реакции, из 1 моль $(NH_4)_2X_2O_7$ образуется 1 моль $X_2O_3$. Следовательно, количества веществ $(\nu)$ относятся как 1:1:
$\nu((NH_4)_2X_2O_7) = \nu(X_2O_3)$
Количество вещества $\nu$ равно отношению массы $m$ к молярной массе $M$ $(\nu = \frac{m}{M})$. Подставим массы из условия и выражения для молярных масс в это равенство:
$\frac{m((NH_4)_2X_2O_7)}{M((NH_4)_2X_2O_7)} = \frac{m(X_2O_3)}{M(X_2O_3)}$
$\frac{10,08}{148 + 2M(X)} = \frac{6,08}{48 + 2M(X)}$
4. Решим полученное уравнение относительно $M(X)$:
$10,08 \cdot (48 + 2M(X)) = 6,08 \cdot (148 + 2M(X))$
$10,08 \cdot 48 + 10,08 \cdot 2M(X) = 6,08 \cdot 148 + 6,08 \cdot 2M(X)$
$483,84 + 20,16 \cdot M(X) = 899,84 + 12,16 \cdot M(X)$
$20,16 \cdot M(X) - 12,16 \cdot M(X) = 899,84 - 483,84$
$8 \cdot M(X) = 416$
$M(X) = \frac{416}{8} = 52 \text{ г/моль}$
5. Определим элемент X. Находим в Периодической системе химических элементов Д.И. Менделеева элемент с относительной атомной массой, равной 52. Этим элементом является хром (Cr), его относительная атомная масса равна 51,996.
Исходное вещество — дихромат аммония $(NH_4)_2Cr_2O_7$, который при нагревании разлагается с образованием оксида хрома(III) $Cr_2O_3$, азота и воды. Эта реакция известна как "вулканчик".
Ответ:
Элемент X — хром (Cr).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 43 расположенного на странице 20 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №43 (с. 20), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














