Номер 51, страница 24 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 1. Введение в органическую химию. 1.1. Задачи для повторения - номер 51, страница 24.
№51 (с. 24)
Условие. №51 (с. 24)
скриншот условия


51. Зеленый гоблин — знаменитый враг Человека-паука.
Как стало известно, под маской Зеленого гоблина скрывался бизнесмен Норман Озборн, который после неудачного эксперимента с так называемым ОЗ-веществом обрел сверхчеловеческие способности, но вместе с тем его разум серьезно пострадал (рис. 7).
ОЗ-вещество представляло собой жидкость зеленого цвета. После смерти Нормана Озборна формула ОЗ-вещества была утеряна. Тем не менее на черном злодейском рынке время от времени появлялись подделки. Одна из грубых подделок ОЗ-вещества представляла собой очень нестабильную жидкость. Исследования показали, что жидкость имела состав $Э_2O_7$ и содержала 50,5 % кислорода по массе.
а) Установите формулу подделки.
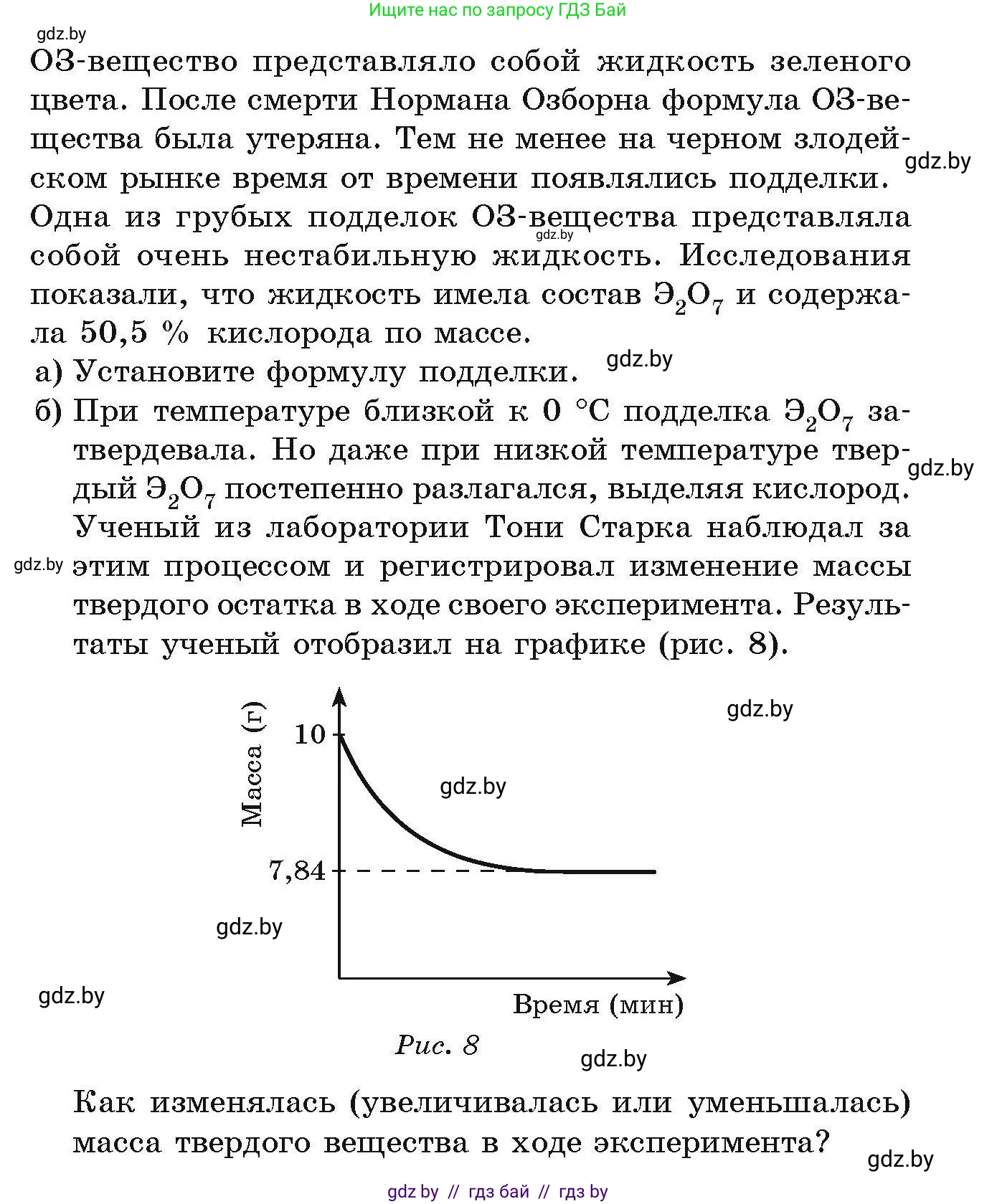
б) При температуре близкой к $0 \ ^\circ C$ подделка $Э_2O_7$ затвердевала. Но даже при низкой температуре твердый $Э_2O_7$ постепенно разлагался, выделяя кислород. Ученый из лаборатории Тони Старка наблюдал за этим процессом и регистрировал изменение массы твердого остатка в ходе своего эксперимента. Результаты ученый отобразил на графике (рис. 8).
Масса (г)
10
7,84
Время (мин)
Рис. 8
Как изменялась (увеличивалась или уменьшалась) масса твердого вещества в ходе эксперимента?
в) На сколько процентов изменилась масса твердого вещества в ходе эксперимента?
г) Установите формулу твердого остатка, полученного в ходе эксперимента.
Решение. №51 (с. 24)

Решение 2. №51 (с. 24)
а) Установите формулу подделки.
Дано:
Формула вещества: $Э_2O_7$
Массовая доля кислорода $ω(O) = 50,5 \% = 0,505$
Относительная атомная масса кислорода $Ar(O) = 16$
Найти:
Химический элемент Э.
Решение:
Массовая доля кислорода в оксиде $Э_2O_7$ вычисляется по формуле:
$ω(O) = \frac{7 \cdot Ar(O)}{2 \cdot Ar(Э) + 7 \cdot Ar(O)}$
Пусть $x$ – относительная атомная масса элемента Э. Подставим известные значения в формулу:
$0,505 = \frac{7 \cdot 16}{2 \cdot x + 7 \cdot 16}$
$0,505 = \frac{112}{2x + 112}$
Решим уравнение относительно $x$:
$0,505 \cdot (2x + 112) = 112$
$1,01x + 56,56 = 112$
$1,01x = 112 - 56,56$
$1,01x = 55,44$
$x = \frac{55,44}{1,01} \approx 54,89$
Относительная атомная масса элемента Э близка к 55. В периодической системе химических элементов Д.И. Менделеева этому значению соответствует марганец (Mn).
Следовательно, формула подделки ОЗ-вещества – $Mn_2O_7$ (оксид марганца(VII)).
Ответ: Формула подделки – $Mn_2O_7$.
б) Как изменялась (увеличивалась или уменьшалась) масса твердого вещества в ходе эксперимента?
Согласно графику (рис. 8), кривая, отражающая массу твердого вещества, идет вниз с течением времени. В начальный момент времени масса составляла 10 г, а по окончании процесса разложения стабилизировалась на отметке 7,84 г. Это означает, что масса твердого вещества в ходе эксперимента уменьшалась. Уменьшение массы произошло за счет выделения и улетучивания газообразного кислорода в результате разложения исходного вещества.
Ответ: Масса твердого вещества в ходе эксперимента уменьшалась.
в) На сколько процентов изменилась масса твердого вещества в ходе эксперимента?
Дано:
Начальная масса вещества $m_{нач} = 10 \text{ г}$
Конечная масса вещества $m_{кон} = 7,84 \text{ г}$
Найти:
Процентное изменение массы $\Delta ω$.
Решение:
1. Найдем абсолютное изменение массы:
$\Delta m = m_{нач} - m_{кон} = 10 - 7,84 = 2,16 \text{ г}$
2. Рассчитаем процентное изменение массы относительно начальной массы:
$\Delta ω = \frac{\Delta m}{m_{нач}} \cdot 100\% = \frac{2,16}{10} \cdot 100\% = 21,6\%$
Ответ: Масса твердого вещества в ходе эксперимента уменьшилась на 21,6%.
г) Установите формулу твердого остатка, полученного в ходе эксперимента.
Дано:
Формула исходного вещества: $Mn_2O_7$
Начальная масса $m(Mn_2O_7) = 10 \text{ г}$
Конечная масса твердого остатка $m_{ост} = 7,84 \text{ г}$
Найти:
Формулу твердого остатка.
Решение:
1. В ходе эксперимента исходное вещество $Mn_2O_7$ разлагалось с выделением кислорода. Масса выделившегося кислорода равна разности начальной и конечной масс твердой фазы:
$m(O_2) = m(Mn_2O_7) - m_{ост} = 10 - 7,84 = 2,16 \text{ г}$
2. Найдем количество вещества (в молях) марганца в исходном образце и количество вещества выделившегося кислорода. Молярные массы: $M(Mn) \approx 55 \text{ г/моль}$, $M(O) = 16 \text{ г/моль}$.
$M(Mn_2O_7) = 2 \cdot 55 + 7 \cdot 16 = 110 + 112 = 222 \text{ г/моль}$
Количество вещества исходного оксида:
$n(Mn_2O_7) = \frac{m(Mn_2O_7)}{M(Mn_2O_7)} = \frac{10}{222} \approx 0,04505 \text{ моль}$
Количество вещества атомов марганца в остатке (марганец не улетучивается):
$n(Mn) = 2 \cdot n(Mn_2O_7) = 2 \cdot 0,04505 \approx 0,0901 \text{ моль}$
3. Масса марганца в остатке:
$m(Mn) = n(Mn) \cdot M(Mn) = 0,0901 \cdot 55 \approx 4,955 \text{ г}$
4. Твердый остаток состоит из марганца и кислорода. Найдем массу кислорода в остатке:
$m(O)_{ост} = m_{ост} - m(Mn) = 7,84 - 4,955 = 2,885 \text{ г}$
5. Найдем количество вещества атомов кислорода в остатке:
$n(O)_{ост} = \frac{m(O)_{ост}}{M(O)} = \frac{2,885}{16} \approx 0,1803 \text{ моль}$
6. Найдем соотношение молей марганца и кислорода в твердом остатке:
$n(Mn) : n(O)_{ост} = 0,0901 : 0,1803$
Разделим оба числа на наименьшее (0,0901), чтобы найти простейшее целочисленное соотношение:
$\frac{0,0901}{0,0901} : \frac{0,1803}{0,0901} \approx 1 : 2$
Таким образом, простейшая формула твердого остатка – $MnO_2$ (оксид марганца(IV)).
Ответ: Формула твердого остатка – $MnO_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 51 расположенного на странице 24 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №51 (с. 24), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














