Номер 1318, страница 203 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 45. Общие способы получения металлов - номер 1318, страница 203.
№1318 (с. 203)
Условие. №1318 (с. 203)
скриншот условия

1318. Составьте уравнения химических реакций, протекающих при электролизе:
а) водного раствора хлорида натрия;
б) расплава бромида алюминия;
в) расплава хлорида кальция;
г) водного раствора сульфата калия;
д) расплава хлорида цинка;
е) водного раствора нитрата меди(II).
Решение. №1318 (с. 203)
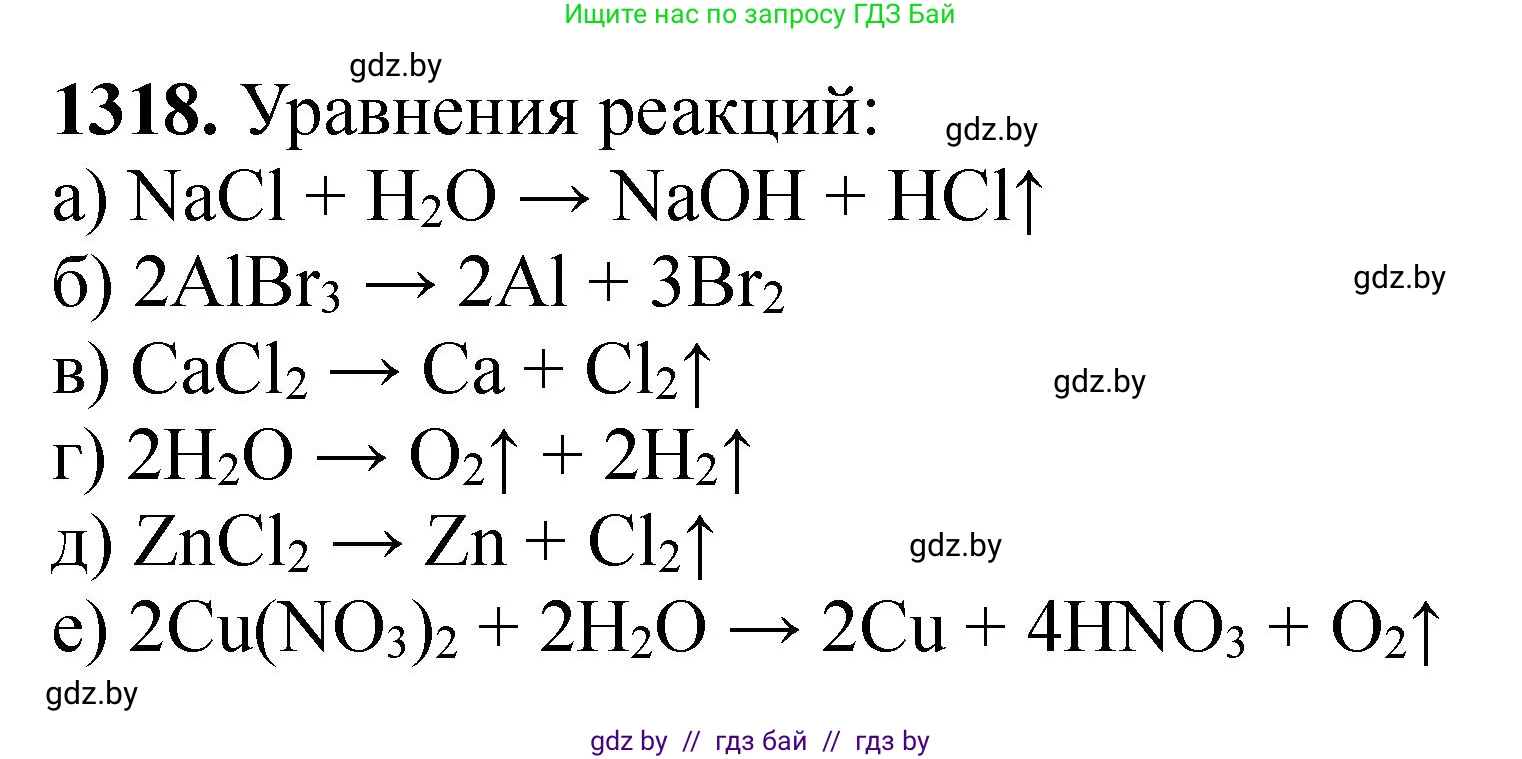
Решение 3. №1318 (с. 203)
а) водного раствора хлорида натрия
При электролизе водного раствора хлорида натрия $NaCl$ в растворе присутствуют ионы $Na^+$, $Cl^-$ и молекулы воды $H_2O$.
На катоде (отрицательном электроде) происходит процесс восстановления. Конкурируют катионы $Na^+$ и молекулы $H_2O$. Так как натрий – активный металл (стоит в ряду напряжений до алюминия), восстанавливаться будут молекулы воды:
Катод (-): $2H_2O + 2e^- \rightarrow H_2 \uparrow + 2OH^-$
На аноде (положительном электроде) происходит процесс окисления. Конкурируют анионы $Cl^-$ и молекулы $H_2O$. Хлорид-ионы окисляются, так как они относятся к бескислородным анионам (кроме $F^-$):
Анод (+): $2Cl^- - 2e^- \rightarrow Cl_2 \uparrow$
В растворе остаются ионы $Na^+$ и образуются гидроксид-ионы $OH^-$, которые составляют гидроксид натрия $NaOH$.
Суммарное уравнение реакции электролиза:
Ответ: $2NaCl + 2H_2O \xrightarrow{электролиз} 2NaOH + H_2 \uparrow + Cl_2 \uparrow$
б) расплава бромида алюминия
При электролизе расплава бромида алюминия $AlBr_3$ присутствуют только ионы $Al^{3+}$ и $Br^-$.
На катоде (отрицательном электроде) восстанавливаются катионы алюминия:
Катод (-): $Al^{3+} + 3e^- \rightarrow Al$
На аноде (положительном электроде) окисляются бромид-ионы:
Анод (+): $2Br^- - 2e^- \rightarrow Br_2$
Для составления суммарного уравнения необходимо уравнять число электронов, для этого умножим катодный процесс на 2, а анодный на 3:
$2Al^{3+} + 6e^- \rightarrow 2Al$
$6Br^- - 6e^- \rightarrow 3Br_2$
Суммарное уравнение реакции электролиза:
Ответ: $2AlBr_3 \xrightarrow{электролиз} 2Al + 3Br_2$
в) расплава хлорида кальция
При электролизе расплава хлорида кальция $CaCl_2$ присутствуют ионы $Ca^{2+}$ и $Cl^-$.
На катоде (отрицательном электроде) восстанавливаются катионы кальция:
Катод (-): $Ca^{2+} + 2e^- \rightarrow Ca$
На аноде (положительном электроде) окисляются хлорид-ионы:
Анод (+): $2Cl^- - 2e^- \rightarrow Cl_2 \uparrow$
Число отданных и принятых электронов равно, поэтому суммарное уравнение имеет вид:
Ответ: $CaCl_2 \xrightarrow{электролиз} Ca + Cl_2 \uparrow$
г) водного раствора сульфата калия
При электролизе водного раствора сульфата калия $K_2SO_4$ в растворе присутствуют ионы $K^+$, $SO_4^{2-}$ и молекулы воды $H_2O$.
На катоде (отрицательном электроде) конкурируют катионы $K^+$ и молекулы $H_2O$. Калий – активный металл, поэтому восстанавливаются молекулы воды:
Катод (-): $2H_2O + 2e^- \rightarrow H_2 \uparrow + 2OH^-$
На аноде (положительном электроде) конкурируют анионы $SO_4^{2-}$ и молекулы $H_2O$. Сульфат-ион является кислородсодержащим, поэтому окисляются молекулы воды:
Анод (+): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
Таким образом, катионы и анионы соли не участвуют в окислительно-восстановительных процессах. Происходит электролиз воды, а сульфат калия лишь увеличивает электропроводность раствора.
Суммарное уравнение реакции электролиза:
Ответ: $2H_2O \xrightarrow{электролиз} 2H_2 \uparrow + O_2 \uparrow$
д) расплава хлорида цинка
При электролизе расплава хлорида цинка $ZnCl_2$ присутствуют ионы $Zn^{2+}$ и $Cl^-$.
На катоде (отрицательном электроде) восстанавливаются катионы цинка:
Катод (-): $Zn^{2+} + 2e^- \rightarrow Zn$
На аноде (положительном электроде) окисляются хлорид-ионы:
Анод (+): $2Cl^- - 2e^- \rightarrow Cl_2 \uparrow$
Суммарное уравнение реакции электролиза:
Ответ: $ZnCl_2 \xrightarrow{электролиз} Zn + Cl_2 \uparrow$
е) водного раствора нитрата меди(II)
При электролизе водного раствора нитрата меди(II) $Cu(NO_3)_2$ в растворе присутствуют ионы $Cu^{2+}$, $NO_3^{-}$ и молекулы воды $H_2O$.
На катоде (отрицательном электроде) конкурируют катионы $Cu^{2+}$ и молекулы $H_2O$. Медь – малоактивный металл (стоит в ряду напряжений после водорода), поэтому восстанавливаются катионы меди:
Катод (-): $Cu^{2+} + 2e^- \rightarrow Cu \downarrow$
На аноде (положительном электроде) конкурируют анионы $NO_3^{-}$ и молекулы $H_2O$. Нитрат-ион является кислородсодержащим, поэтому окисляются молекулы воды:
Анод (+): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
Уравняем число электронов, умножив катодный процесс на 2:
$2Cu^{2+} + 4e^- \rightarrow 2Cu \downarrow$
В растворе остаются нитрат-ионы $NO_3^-$ и образуются ионы водорода $H^+$, которые составляют азотную кислоту $HNO_3$.
Суммарное уравнение реакции электролиза:
Ответ: $2Cu(NO_3)_2 + 2H_2O \xrightarrow{электролиз} 2Cu \downarrow + O_2 \uparrow + 4HNO_3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1318 расположенного на странице 203 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1318 (с. 203), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














