Номер 1334, страница 205 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 45. Общие способы получения металлов. 1. *Получение металлов электролизом водных растворов солей - номер 1334, страница 205.
№1334 (с. 205)
Условие. №1334 (с. 205)
скриншот условия

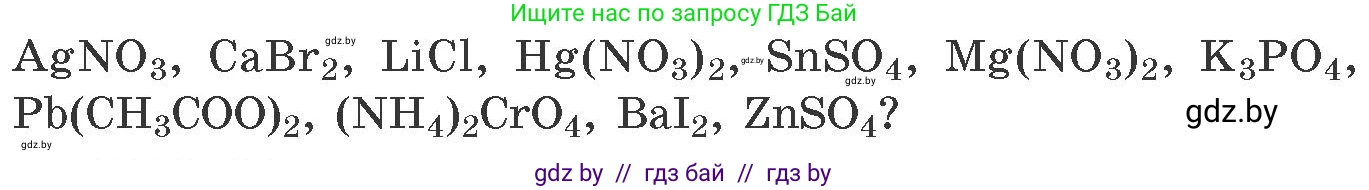
1334. *При электролизе водных растворов каких солей можно практически получить соответствующий металл: $AgNO_3$, $CaBr_2$, $LiCl$, $Hg(NO_3)_2$, $SnSO_4$, $Mg(NO_3)_2$, $K_3PO_4$, $Pb(CH_3COO)_2$, $(NH_4)_2CrO_4$, $BaI_2$, $ZnSO_4$?
Решение. №1334 (с. 205)
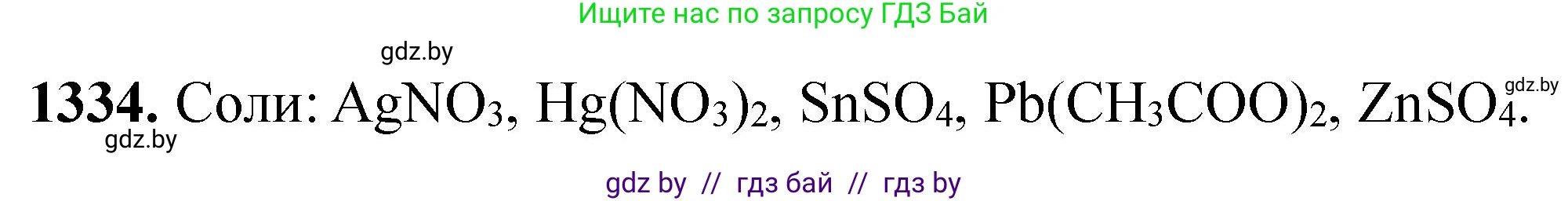
Решение 3. №1334 (с. 205)
Для определения возможности получения металла при электролизе водного раствора соли необходимо сравнить электрохимическую активность катиона металла и воды. Общее правило основано на положении металла в ряду стандартных электродных потенциалов (ряду активности металлов):
- Металлы, стоящие в ряду активности до алюминия включительно (например, Li, K, Ba, Ca, Mg), являются очень активными. В водных растворах их катионы не восстанавливаются на катоде. Вместо этого происходит восстановление молекул воды с выделением водорода: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$.
- Металлы, стоящие в ряду активности между алюминием и водородом (например, Zn, Sn, Pb), являются металлами средней активности. В водных растворах их восстановление на катоде конкурирует с восстановлением воды. Практическое получение металла возможно, но часто сопровождается выделением водорода. Результат зависит от концентрации раствора, материала катода (перенапряжение водорода), плотности тока и pH среды. Для этих металлов получение в чистом виде возможно.
- Металлы, стоящие в ряду активности после водорода (например, Cu, Hg, Ag), являются неактивными. В водных растворах их катионы восстанавливаются на катоде до свободных металлов, так как этот процесс энергетически выгоднее восстановления воды.
Рассмотрим каждую соль отдельно.
AgNO₃
Серебро (Ag) — металл, стоящий в ряду активности после водорода (неактивный металл). Поэтому при электролизе его катионы $Ag^+$ будут восстанавливаться на катоде, а не молекулы воды.
Катодный процесс: $Ag^+ + e^- \rightarrow Ag \downarrow$
Ответ: Да, можно получить металлическое серебро.
CaBr₂
Кальций (Ca) — активный щелочноземельный металл, стоящий в ряду активности до алюминия. В водном растворе на катоде будут восстанавливаться молекулы воды, а не катионы $Ca^{2+}$.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, получить металлический кальций нельзя.
LiCl
Литий (Li) — активный щелочной металл, стоящий в самом начале ряда активности. В водном растворе на катоде будут восстанавливаться молекулы воды, а не катионы $Li^+$.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, получить металлический литий нельзя.
Hg(NO₃)₂
Ртуть (Hg) — металл, стоящий в ряду активности после водорода. Катионы ртути $Hg^{2+}$ будут восстанавливаться на катоде.
Катодный процесс: $Hg^{2+} + 2e^- \rightarrow Hg \downarrow$
Ответ: Да, можно получить металлическую ртуть.
SnSO₄
Олово (Sn) — металл средней активности, стоящий в ряду активности до водорода. Восстановление катионов $Sn^{2+}$ конкурирует с восстановлением воды, но из-за перенапряжения водорода на олове и подбора условий электролиза (концентрация, pH) можно практически осуществить выделение металлического олова.
Катодный процесс: $Sn^{2+} + 2e^- \rightarrow Sn \downarrow$
Ответ: Да, можно получить металлическое олово.
Mg(NO₃)₂
Магний (Mg) — активный металл, стоящий в ряду активности до алюминия. В водном растворе на катоде будут восстанавливаться молекулы воды, а не катионы $Mg^{2+}$.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, получить металлический магний нельзя.
K₃PO₄
Калий (K) — активный щелочной металл. В водном растворе на катоде будут восстанавливаться молекулы воды, а не катионы $K^+$.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, получить металлический калий нельзя.
Pb(CH₃COO)₂
Свинец (Pb) — металл средней активности, стоящий в ряду активности до водорода. Как и в случае с оловом, на катоде возможно восстановление катионов $Pb^{2+}$ до металла, особенно при подходящих условиях.
Катодный процесс: $Pb^{2+} + 2e^- \rightarrow Pb \downarrow$
Ответ: Да, можно получить металлический свинец.
(NH₄)₂CrO₄
Катион в этой соли — аммоний $NH_4^+$, а не катион металла. На катоде будет происходить восстановление воды. Получить металл из катиона аммония невозможно.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, так как катион не является катионом металла, который можно восстановить до простого вещества.
BaI₂
Барий (Ba) — активный щелочноземельный металл. В водном растворе на катоде будут восстанавливаться молекулы воды, а не катионы $Ba^{2+}$.
Катодный процесс: $2H_2O + 2e^- \rightarrow H_2\uparrow + 2OH^-$
Ответ: Нет, получить металлический барий нельзя.
ZnSO₄
Цинк (Zn) — металл средней активности. Его стандартный потенциал близок к потенциалу восстановления воды, однако из-за высокого перенапряжения выделения водорода на цинковой поверхности, на катоде преимущественно идет процесс восстановления катионов $Zn^{2+}$. Электролиз раствора сульфата цинка — промышленный способ получения цинка.
Катодный процесс: $Zn^{2+} + 2e^- \rightarrow Zn \downarrow$
Ответ: Да, можно получить металлический цинк.
Таким образом, практически получить соответствующий металл можно при электролизе водных растворов солей: AgNO₃, Hg(NO₃)₂, SnSO₄, Pb(CH₃COO)₂, ZnSO₄.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1334 расположенного на странице 205 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1334 (с. 205), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














