Номер 1441, страница 223 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 49. Железо и его соединения - номер 1441, страница 223.
№1441 (с. 223)
Условие. №1441 (с. 223)
скриншот условия

1441. Определите степень окисления атома железа в со-единениях:
а) $FeCl_2$, $Fe_2O_3$, $Fe(OH)_2$;
б) $K_2FeO_4$, $FeCl_3$, $FeOOH$;
в) $Fe_3O_4$, $K_3[Fe(CN)_6]$, $[Fe(H_2O)_6]Cl_3$;
г) $K[Fe(NH_3)_2(CN)_4]$, $[Fe(H_2O)_2(CN)_4]^-$, $[Fe(H_2O)_6]^{3+}$.
Решение. №1441 (с. 223)
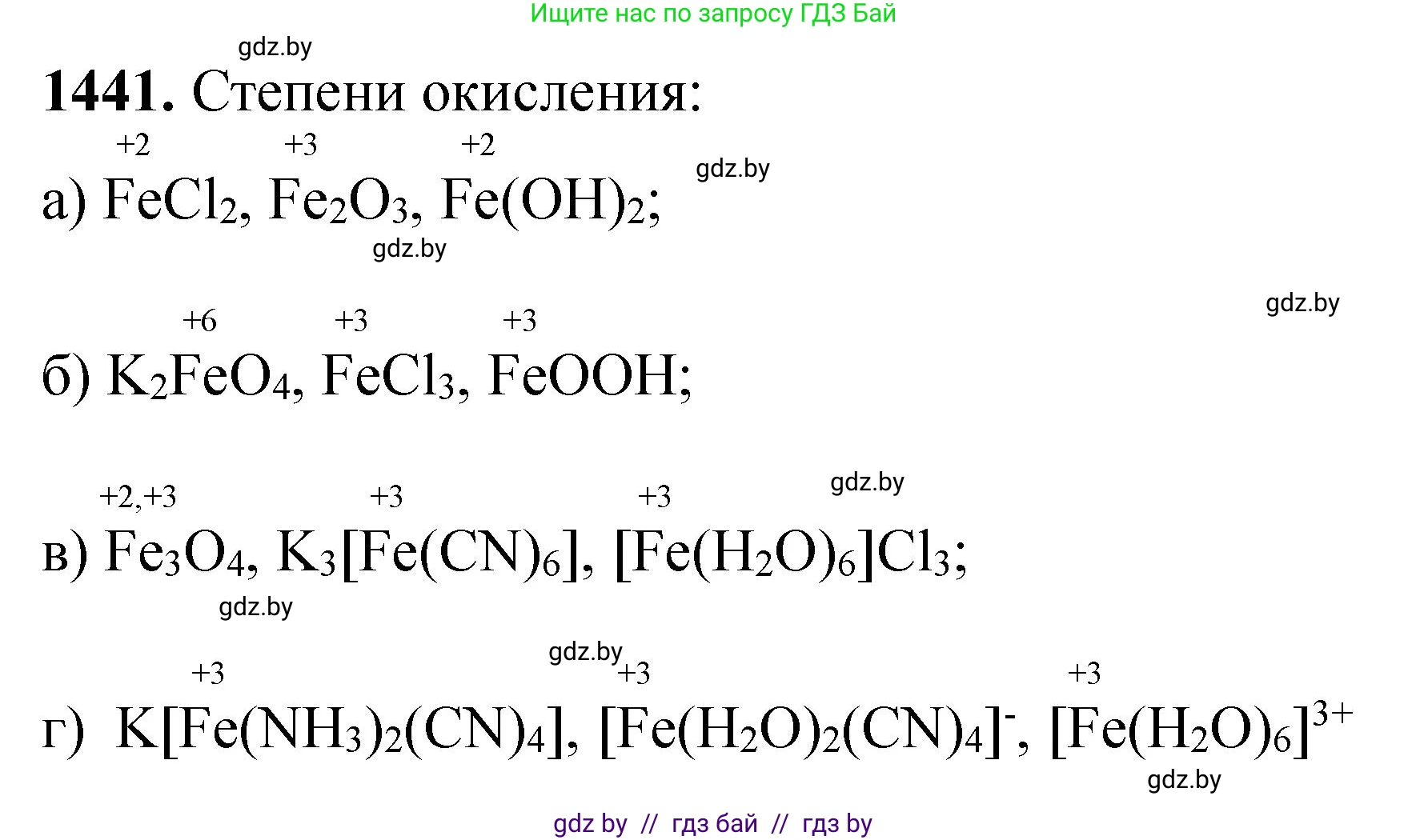
Решение 3. №1441 (с. 223)
Для определения степени окисления атома элемента в соединении или ионе необходимо исходить из следующих правил:
- Сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
- Сумма степеней окисления всех атомов в ионе равна заряду этого иона.
- Степень окисления щелочных металлов (например, K) в соединениях всегда +1.
- Степень окисления кислорода в большинстве соединений (оксидах, гидроксидах) равна -2.
- Степень окисления водорода в большинстве соединений равна +1.
- Степень окисления галогенов (например, Cl) в хлоридах равна -1.
- Лиганды, являющиеся нейтральными молекулами (например, $H_2O$, $NH_3$), имеют заряд 0.
- Заряд гидроксогруппы $(OH)$ равен -1, цианогруппы $(CN)$ — -1.
1. В хлориде железа(II) $FeCl_2$ степень окисления хлора равна -1. Обозначим степень окисления железа за $x$. Так как молекула электронейтральна, сумма степеней окисления равна нулю: $x + 2 \cdot (-1) = 0$ $x - 2 = 0$ $x = +2$.
2. В оксиде железа(III) $Fe_2O_3$ степень окисления кислорода равна -2. Обозначим степень окисления железа за $x$: $2 \cdot x + 3 \cdot (-2) = 0$ $2x - 6 = 0$ $x = +3$.
3. В гидроксиде железа(II) $Fe(OH)_2$ гидроксогруппа $(OH)$ имеет заряд -1. Обозначим степень окисления железа за $x$: $x + 2 \cdot (-1) = 0$ $x - 2 = 0$ $x = +2$.
Ответ: в $FeCl_2$ степень окисления железа +2; в $Fe_2O_3$ — +3; в $Fe(OH)_2$ — +2.
б) K₂FeO₄, FeCl₃, FeOOH;1. В феррате калия $K_2FeO_4$ степень окисления калия равна +1, кислорода — -2. Обозначим степень окисления железа за $x$: $2 \cdot (+1) + x + 4 \cdot (-2) = 0$ $2 + x - 8 = 0$ $x = +6$.
2. В хлориде железа(III) $FeCl_3$ степень окисления хлора равна -1. Обозначим степень окисления железа за $x$: $x + 3 \cdot (-1) = 0$ $x - 3 = 0$ $x = +3$.
3. В гидроксооксиде железа(III) $FeOOH$ степень окисления кислорода равна -2, водорода — +1. Обозначим степень окисления железа за $x$: $x + (-2) + (-2) + (+1) = 0$ $x - 3 = 0$ $x = +3$.
Ответ: в $K_2FeO_4$ степень окисления железа +6; в $FeCl_3$ — +3; в $FeOOH$ — +3.
в) Fe₃O₄, K₃[Fe(CN)₆], [Fe(H₂O)₆]Cl₃;1. Оксид железа(II,III) $Fe_3O_4$ (железная окалина) является смешанным оксидом, его состав можно представить как $FeO \cdot Fe_2O_3$. В этом соединении атомы железа находятся в двух степенях окисления: в $FeO$ степень окисления железа +2, а в $Fe_2O_3$ — +3. Таким образом, в $Fe_3O_4$ один атом железа имеет степень окисления +2, а два других — +3.
2. Гексацианоферрат(III) калия $K_3[Fe(CN)_6]$ — комплексное соединение. Катион калия $K^+$ имеет заряд +1, следовательно, комплексный анион $[Fe(CN)_6]$ имеет заряд -3. Лиганд $CN$ имеет заряд -1. Обозначим степень окисления железа за $x$. Сумма степеней окисления в ионе равна его заряду: $x + 6 \cdot (-1) = -3$ $x - 6 = -3$ $x = +3$.
3. Хлорид гексаакважелеза(III) $[Fe(H_2O)_6]Cl_3$ — комплексное соединение. Анион хлора $Cl^-$ имеет заряд -1, следовательно, комплексный катион $[Fe(H_2O)_6]$ имеет заряд +3. Лиганд $H_2O$ (вода) является нейтральной молекулой (заряд 0). Обозначим степень окисления железа за $x$: $x + 6 \cdot 0 = +3$ $x = +3$.
Ответ: в $Fe_3O_4$ железо имеет две степени окисления: +2 и +3; в $K_3[Fe(CN)_6]$ — +3; в $[Fe(H_2O)_6]Cl_3$ — +3.
г) K[Fe(NH₃)₂(CN)₄], [Fe(H₂O)₂(CN)₄]⁻, [Fe(H₂O)₆]³⁺.1. В соединении $K[Fe(NH_3)_2(CN)_4]$ катион $K^+$ имеет заряд +1, значит, комплексный анион $[Fe(NH_3)_2(CN)_4]$ имеет заряд -1. Лиганд $NH_3$ (аммиак) нейтрален, а лиганд $CN$ имеет заряд -1. Обозначим степень окисления железа за $x$: $x + 2 \cdot 0 + 4 \cdot (-1) = -1$ $x - 4 = -1$ $x = +3$.
2. В комплексном ионе $[Fe(H_2O)_2(CN)_4]^-$ общий заряд равен -1. Лиганд $H_2O$ нейтрален, лиганд $CN$ имеет заряд -1. Обозначим степень окисления железа за $x$: $x + 2 \cdot 0 + 4 \cdot (-1) = -1$ $x - 4 = -1$ $x = +3$.
3. В комплексном ионе $[Fe(H_2O)_6]^{3+}$ общий заряд равен +3. Лиганд $H_2O$ нейтрален. Обозначим степень окисления железа за $x$: $x + 6 \cdot 0 = +3$ $x = +3$.
Ответ: в $K[Fe(NH_3)_2(CN)_4]$ степень окисления железа +3; в $[Fe(H_2O)_2(CN)_4]^-$ — +3; в $[Fe(H_2O)_6]^{3+}$ — +3.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1441 расположенного на странице 223 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1441 (с. 223), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














