Номер 1435, страница 222 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 48. Алюминий и его соединения. 2. *Общая характеристика кислотно-основных свойств оксидов - номер 1435, страница 222.
№1435 (с. 222)
Условие. №1435 (с. 222)
скриншот условия

1435. *Для каждой пары укажите, какая из солей в водном растворе будет подвергаться гидролизу в большей степени при прочих равных условиях:
а) $CrCl_3$ - $CrCl_2$;
б) $KMnO_4$ - $K_2MnO_4$;
в) $Fe_2(SO_4)_3$ - $FeSO_4$;
г) $Mn(NO_3)_2$ - $Mn_2(SO_4)_3$;
д) $TiBr_3$ - $TiBr_4$;
е) $NaCrO_2$ - $Na_2CrO_4$.
Решение. №1435 (с. 222)
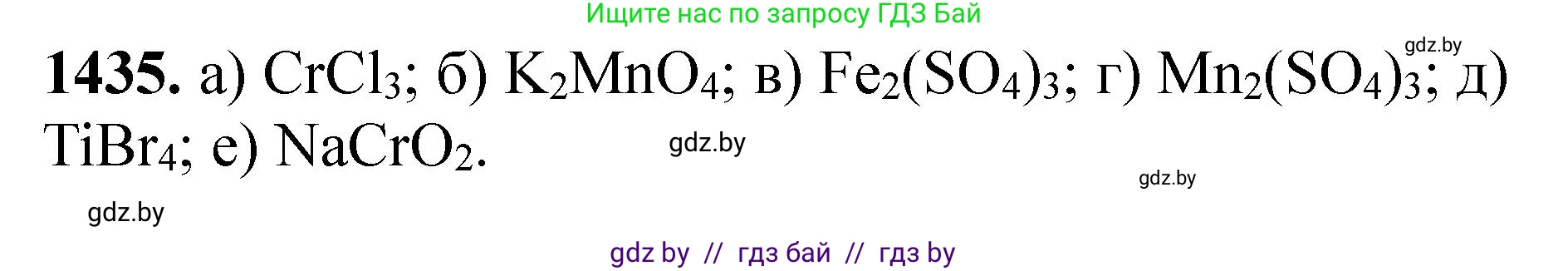
Решение 3. №1435 (с. 222)
Общий принцип, которым мы будем руководствоваться: степень гидролиза соли тем выше, чем слабее кислота или основание, ионами которых она образована.
1. При гидролизе по катиону (соль образована слабым основанием и сильной кислотой) степень гидролиза тем больше, чем выше заряд катиона и меньше его радиус. Для катионов одного и того же элемента, чем выше его степень окисления, тем сильнее гидролиз.
2. При гидролизе по аниону (соль образована сильным основанием и слабой кислотой) степень гидролиза тем больше, чем слабее кислота.
а) $CrCl_3$ — $CrCl_2$
Обе соли образованы катионами металла переменной валентности и анионом сильной соляной кислоты ($HCl$). Следовательно, гидролиз протекает по катиону. Основания $Cr(OH)_2$ и $Cr(OH)_3$ являются слабыми. Степень гидролиза по катиону тем больше, чем выше степень окисления (и заряд) иона металла. В ионе $Cr^{3+}$ (из соли $CrCl_3$) степень окисления хрома +3, а в ионе $Cr^{2+}$ (из соли $CrCl_2$) — +2. Ион $Cr^{3+}$ сильнее поляризует молекулы воды, поэтому гидролиз хлорида хрома(III) протекает в большей степени.
Процесс гидролиза (первая ступень):
$Cr^{3+} + H_2O \rightleftharpoons Cr(OH)^{2+} + H^{+}$
$Cr^{2+} + H_2O \rightleftharpoons Cr(OH)^{+} + H^{+}$
Ответ: $CrCl_3$.
б) $KMnO_4$ — $K_2MnO_4$
Перманганат калия ($KMnO_4$) — соль, образованная сильным основанием ($KOH$) и сильной марганцовой кислотой ($HMnO_4$). Такие соли гидролизу не подвергаются.
Манганат калия ($K_2MnO_4$) — соль, образованная сильным основанием ($KOH$) и слабой марганцоватистой кислотой ($H_2MnO_4$). Гидролиз протекает по аниону $MnO_4^{2-}$.
Процесс гидролиза (первая ступень):
$MnO_4^{2-} + H_2O \rightleftharpoons HMnO_4^{-} + OH^{-}$
Таким образом, гидролизу в большей (и практически единственной) степени подвергается манганат калия.
Ответ: $K_2MnO_4$.
в) $Fe_2(SO_4)_3$ — $FeSO_4$
Обе соли образованы катионами слабого основания ($Fe(OH)_3$ и $Fe(OH)_2$ соответственно) и анионом сильной серной кислоты ($H_2SO_4$). Гидролиз идет по катиону. Ион железа(III) $Fe^{3+}$ имеет больший положительный заряд и меньший ионный радиус по сравнению с ионом железа(II) $Fe^{2+}$, поэтому он является более сильной кислотой Льюиса и гидролизуется в большей степени.
Процесс гидролиза (первая ступень):
$Fe^{3+} + H_2O \rightleftharpoons Fe(OH)^{2+} + H^{+}$
$Fe^{2+} + H_2O \rightleftharpoons Fe(OH)^{+} + H^{+}$
Ответ: $Fe_2(SO_4)_3$.
г) $Mn(NO_3)_2$ — $Mn_2(SO_4)_3$
Обе соли образованы катионами слабого основания ($Mn(OH)_2$ и $Mn(OH)_3$) и анионами сильных кислот ($HNO_3$ и $H_2SO_4$). Гидролиз идет по катиону. Сравниваем ионы $Mn^{2+}$ и $Mn^{3+}$. Чем выше степень окисления и заряд катиона, тем сильнее он гидролизуется. Ион $Mn^{3+}$ имеет больший заряд, чем $Mn^{2+}$, следовательно, сульфат марганца(III) будет гидролизоваться сильнее.
Процесс гидролиза (первая ступень):
$Mn^{3+} + H_2O \rightleftharpoons Mn(OH)^{2+} + H^{+}$
$Mn^{2+} + H_2O \rightleftharpoons Mn(OH)^{+} + H^{+}$
Ответ: $Mn_2(SO_4)_3$.
д) $TiBr_3$ — $TiBr_4$
Обе соли образованы катионами слабого основания ($Ti(OH)_3$ и $Ti(OH)_4$) и анионом сильной бромоводородной кислоты ($HBr$). Гидролиз идет по катиону. Сравниваем ионы $Ti^{3+}$ и $Ti^{4+}$. Ион $Ti^{4+}$ имеет более высокий заряд и меньший радиус, что приводит к более сильной поляризации молекул воды и, соответственно, к большей степени гидролиза.
Процесс гидролиза (первая ступень):
$Ti^{4+} + H_2O \rightleftharpoons Ti(OH)^{3+} + H^{+}$
$Ti^{3+} + H_2O \rightleftharpoons Ti(OH)^{2+} + H^{+}$
Ответ: $TiBr_4$.
е) $NaCrO_2$ — $Na_2CrO_4$
Обе соли образованы катионом сильного основания ($NaOH$) и кислотными остатками. Гидролиз идет по аниону. Степень гидролиза по аниону тем больше, чем слабее соответствующая кислота.
Соль $NaCrO_2$ (хромит натрия) содержит анион $CrO_2^{-}$, соответствующий очень слабой кислоте $HCrO_2$ (гидроксид хрома(III) $Cr(OH)_3$ проявляет амфотерные свойства).
Соль $Na_2CrO_4$ (хромат натрия) содержит анион $CrO_4^{2-}$, соответствующий хромовой кислоте $H_2CrO_4$.
Кислотные свойства соединений элемента усиливаются с ростом его степени окисления. Хромовая кислота ($Cr^{+6}$) является кислотой средней силы, в то время как гидроксид хрома(III) ($Cr^{+3}$) — очень слабое амфотерное основание, т.е. очень слабая кислота. Следовательно, анион $CrO_2^{-}$ является значительно более сильным основанием, чем анион $CrO_4^{2-}$, и гидролизуется в большей степени.
Процесс гидролиза:
$CrO_2^{-} + 2H_2O \rightleftharpoons Cr(OH)_3 + OH^{-}$
$CrO_4^{2-} + H_2O \rightleftharpoons HCrO_4^{-} + OH^{-}$
Ответ: $NaCrO_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1435 расположенного на странице 222 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1435 (с. 222), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














