Номер 1429, страница 221 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 48. Алюминий и его соединения. 1. *Общая характеристика металлов В-групп - номер 1429, страница 221.
№1429 (с. 221)
Условие. №1429 (с. 221)
скриншот условия
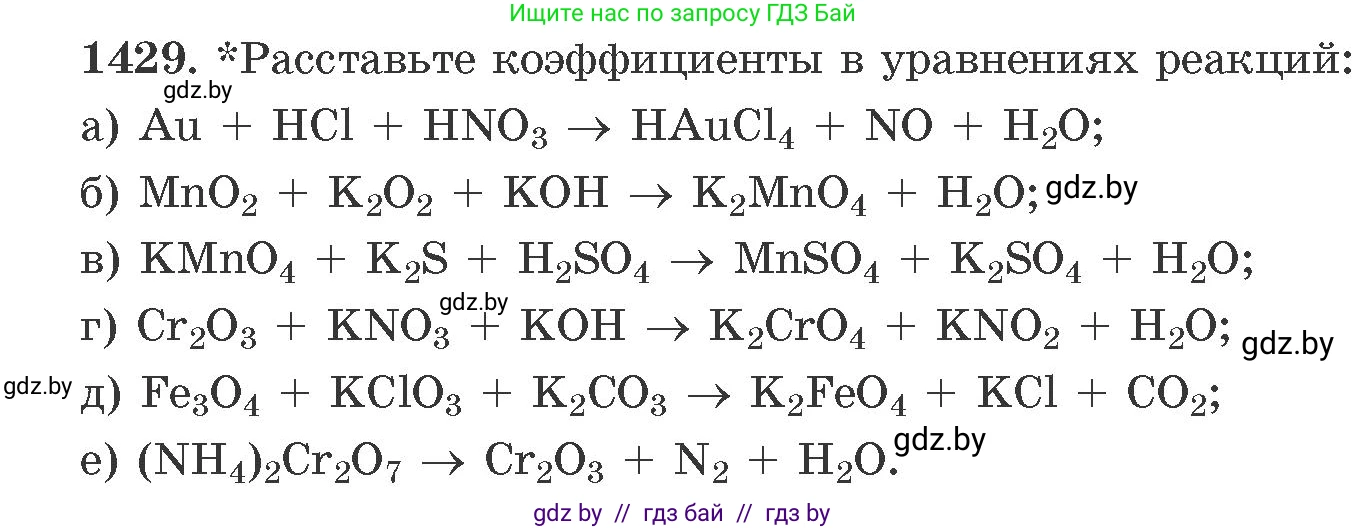
1429. *Расставьте коэффициенты в уравнениях реакций:
a) $Au + HCl + HNO_3 \rightarrow HAuCl_4 + NO + H_2O;$
б) $MnO_2 + K_2O_2 + KOH \rightarrow K_2MnO_4 + H_2O;$
в) $KMnO_4 + K_2S + H_2SO_4 \rightarrow MnSO_4 + K_2SO_4 + H_2O;$
г) $Cr_2O_3 + KNO_3 + KOH \rightarrow K_2CrO_4 + KNO_2 + H_2O;$
д) $Fe_3O_4 + KClO_3 + K_2CO_3 \rightarrow K_2FeO_4 + KCl + CO_2;$
е) $(NH_4)_2Cr_2O_7 \rightarrow Cr_2O_3 + N_2 + H_2O.$
Решение. №1429 (с. 221)

Решение 3. №1429 (с. 221)
а)Решение
Для расстановки коэффициентов в уравнении реакции используем метод электронного баланса. Сначала определим степени окисления элементов, которые их изменяют.
$ \text{Au}^0 + \text{H}\text{Cl} + \text{H}\text{N}^{+5}\text{O}_3 \rightarrow \text{H}\text{Au}^{+3}\text{Cl}_4 + \text{N}^{+2}\text{O} + \text{H}_2\text{O} $
Золото (Au) окисляется, а азот (N) восстанавливается.
Составим полуреакции:
$ \text{Au}^0 - 3\text{e}^- \rightarrow \text{Au}^{+3} $ | 1 (окисление)
$ \text{N}^{+5} + 3\text{e}^- \rightarrow \text{N}^{+2} $ | 1 (восстановление)
Количество отданных и принятых электронов равно, поэтому коэффициенты перед соединениями золота и азота равны 1. Поставим их в уравнение:
$ 1 \text{Au} + \text{HCl} + 1 \text{HNO}_3 \rightarrow 1 \text{HAuCl}_4 + 1 \text{NO} + \text{H}_2\text{O} $
Теперь уравняем остальные элементы. Справа 4 атома хлора (Cl), значит, слева перед HCl нужен коэффициент 4.
$ \text{Au} + 4 \text{HCl} + \text{HNO}_3 \rightarrow \text{HAuCl}_4 + \text{NO} + \text{H}_2\text{O} $
Подсчитаем атомы водорода (H) слева: 4 в HCl и 1 в HNO₃, итого 5. Справа: 1 в HAuCl₄. Значит, в воде должно быть 4 атома водорода, для этого ставим коэффициент 2 перед H₂O.
$ \text{Au} + 4 \text{HCl} + \text{HNO}_3 \rightarrow \text{HAuCl}_4 + \text{NO} + 2 \text{H}_2\text{O} $
Проверим баланс по кислороду (O). Слева 3 атома в HNO₃. Справа 1 в NO и 2 в 2H₂O, итого 3. Баланс соблюден.
Ответ: $ \text{Au} + 4 \text{HCl} + \text{HNO}_3 \rightarrow \text{HAuCl}_4 + \text{NO} + 2 \text{H}_2\text{O} $.
б)Решение
Применим метод электронного баланса. Определим степени окисления изменяющихся элементов.
$ \text{Mn}^{+4}\text{O}_2 + \text{K}_2\text{O}_2^{-1} + \text{KOH} \rightarrow \text{K}_2\text{Mn}^{+6}\text{O}_4 + \text{H}_2\text{O}^{-2} $
Марганец (Mn) окисляется, а кислород (O) из пероксида калия восстанавливается.
Составим полуреакции:
$ \text{Mn}^{+4} - 2\text{e}^- \rightarrow \text{Mn}^{+6} $ | 1 (окисление)
$ 2\text{O}^{-1} + 2\text{e}^- \rightarrow 2\text{O}^{-2} $ | 1 (восстановление)
Из баланса следует, что на 1 моль MnO₂ должен приходиться 1 моль K₂O₂. Поставим коэффициенты 1.
$ 1 \text{MnO}_2 + 1 \text{K}_2\text{O}_2 + \text{KOH} \rightarrow 1 \text{K}_2\text{MnO}_4 + \text{H}_2\text{O} $
При попытке уравнять остальные элементы (K и H) возникает противоречие. Для баланса калия (K) слева: $2 + x$ (где $x$ - коэффициент перед KOH), справа: 2. Отсюда $x=0$. Для баланса водорода (H) слева: $x$, справа: $2y$ (где $y$ - коэффициент перед H₂O). Отсюда $x=2y$. Если $x=0$, то и $y=0$. Это означает, что KOH и H₂O не участвуют в реакции. Данное уравнение в представленном виде не может быть сбалансировано с ненулевыми коэффициентами для KOH и H₂O. Вероятно, в условии допущена опечатка. Сбалансированная реакция между основными реагентами выглядит так:
$ \text{MnO}_2 + \text{K}_2\text{O}_2 \rightarrow \text{K}_2\text{MnO}_4 $
Это уравнение уже сбалансировано по всем элементам (1 Mn, 2 K, 4 O с обеих сторон).
Ответ: Уравнение в исходном виде не балансируется. Сбалансированная реакция между основными реагентами: $ \text{MnO}_2 + \text{K}_2\text{O}_2 \rightarrow \text{K}_2\text{MnO}_4 $.
в)Решение
Определим степени окисления элементов, участвующих в окислительно-восстановительном процессе.
$ \text{K}\text{Mn}^{+7}\text{O}_4 + \text{K}_2\text{S}^{-2} + \text{H}_2\text{S}^{+6}\text{O}_4 \rightarrow \text{Mn}^{+2}\text{SO}_4 + \text{K}_2\text{SO}_4 + \text{H}_2\text{O} $
Марганец (Mn) восстанавливается. Сера (S) из сульфида калия должна окислиться. Так как в продуктах вся сера находится в виде сульфат-ионов (S⁺⁶), предположим, что сера S⁻² окисляется до S⁺⁶.
Составим полуреакции:
$ \text{Mn}^{+7} + 5\text{e}^- \rightarrow \text{Mn}^{+2} $ | 8 (восстановление)
$ \text{S}^{-2} - 8\text{e}^- \rightarrow \text{S}^{+6} $ | 5 (окисление)
Наименьшее общее кратное для 5 и 8 равно 40. Расставляем коэффициенты: 8 перед соединениями марганца и 5 перед соединениями сульфидной серы.
$ 8 \text{KMnO}_4 + 5 \text{K}_2\text{S} + \text{H}_2\text{SO}_4 \rightarrow 8 \text{MnSO}_4 + \text{K}_2\text{SO}_4 + \text{H}_2\text{O} $
Уравняем калий (K). Слева: 8 в KMnO₄ и 5 * 2 = 10 в K₂S, итого 18. Справа нужен коэффициент 9 перед K₂SO₄ (9 * 2 = 18).
$ 8 \text{KMnO}_4 + 5 \text{K}_2\text{S} + \text{H}_2\text{SO}_4 \rightarrow 8 \text{MnSO}_4 + 9 \text{K}_2\text{SO}_4 + \text{H}_2\text{O} $
Уравняем серу (S). Справа: 8 в MnSO₄ и 9 в K₂SO₄, итого 17. Слева: 5 в K₂S. Значит, в H₂SO₄ должно быть 17 - 5 = 12 атомов серы. Ставим коэффициент 12 перед H₂SO₄.
$ 8 \text{KMnO}_4 + 5 \text{K}_2\text{S} + 12 \text{H}_2\text{SO}_4 \rightarrow 8 \text{MnSO}_4 + 9 \text{K}_2\text{SO}_4 + \text{H}_2\text{O} $
Уравняем водород (H). Слева 12 * 2 = 24. Справа ставим коэффициент 12 перед H₂O (12 * 2 = 24).
$ 8 \text{KMnO}_4 + 5 \text{K}_2\text{S} + 12 \text{H}_2\text{SO}_4 \rightarrow 8 \text{MnSO}_4 + 9 \text{K}_2\text{SO}_4 + 12 \text{H}_2\text{O} $
Проверим кислород (O). Слева: 8*4 + 12*4 = 32 + 48 = 80. Справа: 8*4 + 9*4 + 12*1 = 32 + 36 + 12 = 80. Баланс соблюден.
Ответ: $ 8 \text{KMnO}_4 + 5 \text{K}_2\text{S} + 12 \text{H}_2\text{SO}_4 \rightarrow 8 \text{MnSO}_4 + 9 \text{K}_2\text{SO}_4 + 12 \text{H}_2\text{O} $.
г)Решение
Определим степени окисления изменяющихся элементов.
$ \text{Cr}_2^{+3}\text{O}_3 + \text{K}\text{N}^{+5}\text{O}_3 + \text{KOH} \rightarrow \text{K}_2\text{Cr}^{+6}\text{O}_4 + \text{K}\text{N}^{+3}\text{O}_2 + \text{H}_2\text{O} $
Хром (Cr) окисляется, а азот (N) восстанавливается.
Составим полуреакции, учитывая, что в Cr₂O₃ два атома хрома:
$ 2\text{Cr}^{+3} - 6\text{e}^- \rightarrow 2\text{Cr}^{+6} $ | 1 (окисление)
$ \text{N}^{+5} + 2\text{e}^- \rightarrow \text{N}^{+3} $ | 3 (восстановление)
Ставим коэффициент 1 перед Cr₂O₃ (и 2 перед K₂CrO₄) и 3 перед KNO₃ (и 3 перед KNO₂).
$ 1 \text{Cr}_2\text{O}_3 + 3 \text{KNO}_3 + \text{KOH} \rightarrow 2 \text{K}_2\text{CrO}_4 + 3 \text{KNO}_2 + \text{H}_2\text{O} $
Уравняем калий (K). Справа: 2*2 в K₂CrO₄ и 3 в KNO₂, итого 4 + 3 = 7. Слева: 3 в KNO₃. Значит, перед KOH нужен коэффициент 4.
$ \text{Cr}_2\text{O}_3 + 3 \text{KNO}_3 + 4 \text{KOH} \rightarrow 2 \text{K}_2\text{CrO}_4 + 3 \text{KNO}_2 + \text{H}_2\text{O} $
Уравняем водород (H). Слева 4 в KOH. Справа ставим коэффициент 2 перед H₂O (2*2 = 4).
$ \text{Cr}_2\text{O}_3 + 3 \text{KNO}_3 + 4 \text{KOH} \rightarrow 2 \text{K}_2\text{CrO}_4 + 3 \text{KNO}_2 + 2 \text{H}_2\text{O} $
Проверим кислород (O). Слева: 3 + 3*3 + 4*1 = 3 + 9 + 4 = 16. Справа: 2*4 + 3*2 + 2*1 = 8 + 6 + 2 = 16. Баланс соблюден.
Ответ: $ \text{Cr}_2\text{O}_3 + 3 \text{KNO}_3 + 4 \text{KOH} \rightarrow 2 \text{K}_2\text{CrO}_4 + 3 \text{KNO}_2 + 2 \text{H}_2\text{O} $.
д)Решение
Определим степени окисления. Fe₃O₄ - смешанный оксид (FeO·Fe₂O₃), содержащий железо в степенях окисления +2 и +3.
$ \text{Fe}_3^{+8/3}\text{O}_4 + \text{K}\text{Cl}^{+5}\text{O}_3 + \text{K}_2\text{CO}_3 \rightarrow \text{K}_2\text{Fe}^{+6}\text{O}_4 + \text{K}\text{Cl}^{-1} + \text{CO}_2 $
Железо (Fe) окисляется, хлор (Cl) восстанавливается.
Составим полуреакции. Для одной формульной единицы Fe₃O₄ (1 атом Fe⁺² и 2 атома Fe⁺³):
$ \text{Fe}^{+2} - 4\text{e}^- \rightarrow \text{Fe}^{+6} $
$ 2\text{Fe}^{+3} - 6\text{e}^- \rightarrow 2\text{Fe}^{+6} $
Суммарно: $ \text{Fe}_3\text{O}_4 - 10\text{e}^- \rightarrow 3\text{Fe}^{+6} $ | 3 (окисление)
$ \text{Cl}^{+5} + 6\text{e}^- \rightarrow \text{Cl}^{-1} $ | 5 (восстановление)
Ставим коэффициент 3 перед Fe₃O₄ (и 3*3=9 перед K₂FeO₄) и 5 перед KClO₃ (и 5 перед KCl).
$ 3 \text{Fe}_3\text{O}_4 + 5 \text{KClO}_3 + \text{K}_2\text{CO}_3 \rightarrow 9 \text{K}_2\text{FeO}_4 + 5 \text{KCl} + \text{CO}_2 $
Уравняем калий (K). Справа: 9*2 в K₂FeO₄ и 5 в KCl, итого 18 + 5 = 23. Слева: 5 в KClO₃. Значит, в K₂CO₃ должно быть 23 - 5 = 18 атомов K. Ставим коэффициент 9 перед K₂CO₃.
$ 3 \text{Fe}_3\text{O}_4 + 5 \text{KClO}_3 + 9 \text{K}_2\text{CO}_3 \rightarrow 9 \text{K}_2\text{FeO}_4 + 5 \text{KCl} + \text{CO}_2 $
Уравняем углерод (C). Слева 9 в K₂CO₃. Справа ставим коэффициент 9 перед CO₂.
$ 3 \text{Fe}_3\text{O}_4 + 5 \text{KClO}_3 + 9 \text{K}_2\text{CO}_3 \rightarrow 9 \text{K}_2\text{FeO}_4 + 5 \text{KCl} + 9 \text{CO}_2 $
Проверим кислород (O). Слева: 3*4 + 5*3 + 9*3 = 12 + 15 + 27 = 54. Справа: 9*4 + 9*2 = 36 + 18 = 54. Баланс соблюден.
Ответ: $ 3 \text{Fe}_3\text{O}_4 + 5 \text{KClO}_3 + 9 \text{K}_2\text{CO}_3 \rightarrow 9 \text{K}_2\text{FeO}_4 + 5 \text{KCl} + 9 \text{CO}_2 $.
е)Решение
Это реакция внутримолекулярного окисления-восстановления. Определим степени окисления азота и хрома в дихромате аммония.
$ (\text{N}^{-3}\text{H}_4)_2\text{Cr}_2^{+6}\text{O}_7 \rightarrow \text{Cr}_2^{+3}\text{O}_3 + \text{N}_2^{0} + \text{H}_2\text{O} $
Азот (N) в ионе аммония окисляется, хром (Cr) в дихромат-ионе восстанавливается.
Составим полуреакции, учитывая количество атомов в исходном веществе:
$ 2\text{N}^{-3} - 6\text{e}^- \rightarrow \text{N}_2^{0} $ (окисление)
$ 2\text{Cr}^{+6} + 6\text{e}^- \rightarrow 2\text{Cr}^{+3} $ (восстановление)
Число отданных и принятых электронов равно (6), поэтому соотношение окислителя и восстановителя в молекуле уже 1:1. Коэффициент перед (NH₄)₂Cr₂O₇ равен 1.
$ 1 (\text{NH}_4)_2\text{Cr}_2\text{O}_7 \rightarrow 1 \text{Cr}_2\text{O}_3 + 1 \text{N}_2 + \text{H}_2\text{O} $
Уравняем водород (H). Слева 2 * 4 = 8. Справа ставим коэффициент 4 перед H₂O (4 * 2 = 8).
$ (\text{NH}_4)_2\text{Cr}_2\text{O}_7 \rightarrow \text{Cr}_2\text{O}_3 + \text{N}_2 + 4 \text{H}_2\text{O} $
Проверим кислород (O). Слева 7. Справа 3 в Cr₂O₃ и 4 в 4H₂O, итого 7. Баланс соблюден.
Ответ: $ (\text{NH}_4)_2\text{Cr}_2\text{O}_7 \rightarrow \text{Cr}_2\text{O}_3 + \text{N}_2 + 4 \text{H}_2\text{O} $.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1429 расположенного на странице 221 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1429 (с. 221), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














