Номер 1434, страница 222 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 48. Алюминий и его соединения. 2. *Общая характеристика кислотно-основных свойств оксидов - номер 1434, страница 222.
№1434 (с. 222)
Условие. №1434 (с. 222)
скриншот условия

1434. *Составьте молекулярные и ионные уравнения гидролиза следующих солей: сульфат железа(III), хлорид цинка, нитрат хрома(III), ацетат меди(II), йодид марганца(II), Укажите реакцию среды в каждом из растворов.
Решение. №1434 (с. 222)
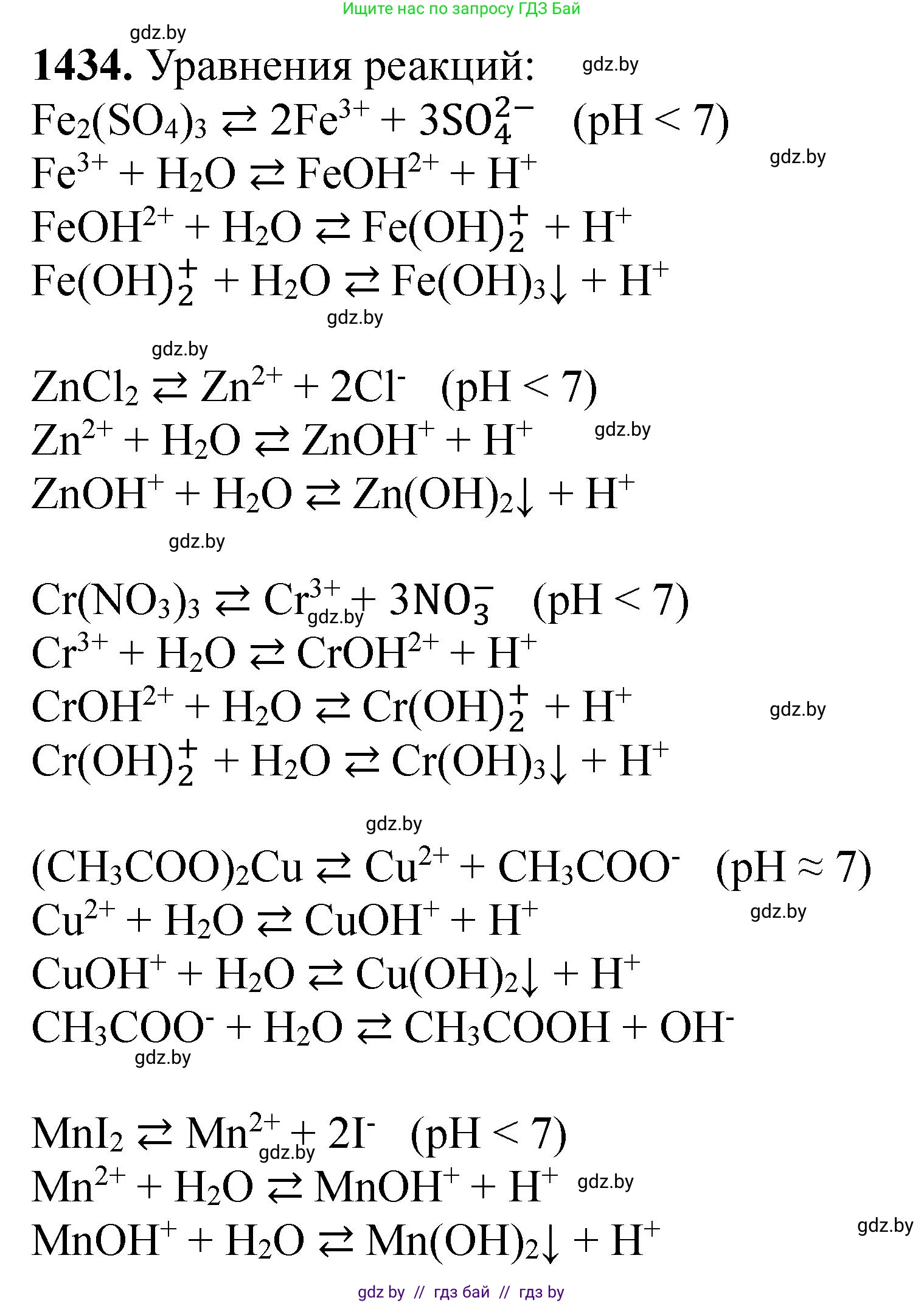
Решение 3. №1434 (с. 222)
Гидролиз солей — это реакция обменного взаимодействия ионов соли с молекулами воды, приводящая к образованию слабого электролита (слабой кислоты или слабого основания) и изменению pH раствора.
Сульфат железа(III)
Сульфат железа(III), $Fe_2(SO_4)_3$, — соль, образованная катионом слабого основания ($Fe(OH)_3$) и анионом сильной кислоты ($H_2SO_4$). Гидролиз протекает по катиону $Fe^{3+}$.
Молекулярное уравнение гидролиза (по первой ступени):
$Fe_2(SO_4)_3 + 2H_2O \rightleftharpoons 2Fe(OH)SO_4 + H_2SO_4$
Полное ионное уравнение:
$2Fe^{3+} + 3SO_4^{2-} + 2H_2O \rightleftharpoons 2Fe(OH)^{2+} + 2SO_4^{2-} + 2H^+ + SO_4^{2-}$
Сокращенное ионное уравнение:
$Fe^{3+} + H_2O \rightleftharpoons Fe(OH)^{2+} + H^+$
В результате реакции в растворе накапливаются ионы водорода $H^+$, что создает кислую среду.
Ответ: Молекулярное уравнение: $Fe_2(SO_4)_3 + 2H_2O \rightleftharpoons 2Fe(OH)SO_4 + H_2SO_4$. Сокращенное ионное уравнение: $Fe^{3+} + H_2O \rightleftharpoons Fe(OH)^{2+} + H^+$. Реакция среды кислая (pH < 7).
Хлорид цинка
Хлорид цинка, $ZnCl_2$, — соль, образованная катионом слабого основания ($Zn(OH)_2$) и анионом сильной кислоты ($HCl$). Гидролиз протекает по катиону $Zn^{2+}$.
Молекулярное уравнение гидролиза (по первой ступени):
$ZnCl_2 + H_2O \rightleftharpoons Zn(OH)Cl + HCl$
Полное ионное уравнение:
$Zn^{2+} + 2Cl^- + H_2O \rightleftharpoons Zn(OH)^+ + Cl^- + H^+ + Cl^-$
Сокращенное ионное уравнение:
$Zn^{2+} + H_2O \rightleftharpoons Zn(OH)^+ + H^+$
Накопление ионов $H^+$ в растворе обуславливает кислую среду.
Ответ: Молекулярное уравнение: $ZnCl_2 + H_2O \rightleftharpoons Zn(OH)Cl + HCl$. Сокращенное ионное уравнение: $Zn^{2+} + H_2O \rightleftharpoons Zn(OH)^+ + H^+$. Реакция среды кислая (pH < 7).
Нитрат хрома(III)
Нитрат хрома(III), $Cr(NO_3)_3$, — соль, образованная катионом слабого основания ($Cr(OH)_3$) и анионом сильной кислоты ($HNO_3$). Гидролиз протекает по катиону $Cr^{3+}$.
Молекулярное уравнение гидролиза (по первой ступени):
$Cr(NO_3)_3 + H_2O \rightleftharpoons Cr(OH)(NO_3)_2 + HNO_3$
Полное ионное уравнение:
$Cr^{3+} + 3NO_3^- + H_2O \rightleftharpoons Cr(OH)^{2+} + 2NO_3^- + H^+ + NO_3^-$
Сокращенное ионное уравнение:
$Cr^{3+} + H_2O \rightleftharpoons Cr(OH)^{2+} + H^+$
В растворе образуются ионы водорода $H^+$, среда становится кислой.
Ответ: Молекулярное уравнение: $Cr(NO_3)_3 + H_2O \rightleftharpoons Cr(OH)(NO_3)_2 + HNO_3$. Сокращенное ионное уравнение: $Cr^{3+} + H_2O \rightleftharpoons Cr(OH)^{2+} + H^+$. Реакция среды кислая (pH < 7).
Ацетат меди(II)
Ацетат меди(II), $Cu(CH_3COO)_2$, — соль, образованная катионом слабого основания ($Cu(OH)_2$) и анионом слабой кислоты ($CH_3COOH$). Гидролиз протекает как по катиону, так и по аниону.
Реакция гидролиза по катиону: $Cu^{2+} + H_2O \rightleftharpoons Cu(OH)^+ + H^+$
Реакция гидролиза по аниону: $CH_3COO^- + H_2O \rightleftharpoons CH_3COOH + OH^-$
Так как константа гидролиза катиона меди ($K_{h, Cu^{2+}} \approx 3.3 \cdot 10^{-7}$) больше константы гидролиза ацетат-иона ($K_{h, CH_3COO^-} \approx 5.6 \cdot 10^{-10}$), гидролиз по катиону протекает в большей степени, что приводит к преобладанию ионов $H^+$ над ионами $OH^-$. Среда раствора будет слабокислой.
Суммарное молекулярное уравнение:
$Cu(CH_3COO)_2 + 2H_2O \rightleftharpoons Cu(OH)_2\downarrow + 2CH_3COOH$
Суммарное ионное уравнение (совпадает с полным, так как продукты являются слабыми электролитами):
$Cu^{2+} + 2CH_3COO^- + 2H_2O \rightleftharpoons Cu(OH)_2\downarrow + 2CH_3COOH$
Ответ: Молекулярное уравнение: $Cu(CH_3COO)_2 + 2H_2O \rightleftharpoons Cu(OH)_2\downarrow + 2CH_3COOH$. Ионное уравнение: $Cu^{2+} + 2CH_3COO^- + 2H_2O \rightleftharpoons Cu(OH)_2\downarrow + 2CH_3COOH$. Реакция среды слабокислая (pH < 7).
Йодид марганца(II)
Йодид марганца(II), $MnI_2$, — соль, образованная катионом слабого основания ($Mn(OH)_2$) и анионом сильной кислоты ($HI$). Гидролиз протекает по катиону $Mn^{2+}$.
Молекулярное уравнение гидролиза (по первой ступени):
$MnI_2 + H_2O \rightleftharpoons Mn(OH)I + HI$
Полное ионное уравнение:
$Mn^{2+} + 2I^- + H_2O \rightleftharpoons Mn(OH)^+ + I^- + H^+ + I^-$
Сокращенное ионное уравнение:
$Mn^{2+} + H_2O \rightleftharpoons Mn(OH)^+ + H^+$
Присутствие ионов $H^+$ в растворе создает кислую среду.
Ответ: Молекулярное уравнение: $MnI_2 + H_2O \rightleftharpoons Mn(OH)I + HI$. Сокращенное ионное уравнение: $Mn^{2+} + H_2O \rightleftharpoons Mn(OH)^+ + H^+$. Реакция среды кислая (pH < 7).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1434 расположенного на странице 222 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1434 (с. 222), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














