Номер 578, страница 95 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 22. Химическое равновесие - номер 578, страница 95.
№578 (с. 95)
Условие. №578 (с. 95)
скриншот условия


578. Укажите верные утверждения:
а) все реакции между газами являются необратимыми;
б) обратимыми могут быть гетерогенные реакции;
в) в состоянии химического равновесия концентрации реагентов и продуктов равны;
г) любое внешнее воздействие влияет на положение равновесия (т. е. равновесные концентрации всех веществ);
д) если равновесие достигается с участием только твёрдых реагентов и продуктов, то давление не оказывает влияния на состояние равновесия;
е) если систему, находящуюся в равновесии, нагреть (охладить), то она переходит в новое состояние равновесия;
ж) в равновесной системе в ответ на повышение давления происходит уменьшение числа газообразных частиц;
з) повышение температуры ускоряет как прямую, так и обратную реакции, но в разной степени;
и) при добавлении в равновесную систему реагентов или продуктов их равновесные концентрации не изменяются.
Решение. №578 (с. 95)
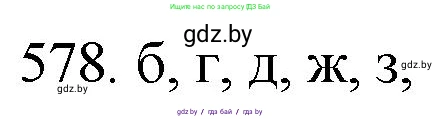
Решение 3. №578 (с. 95)
Проанализируем каждое утверждение:
а) все реакции между газами являются необратимыми;
Утверждение неверно. Многие реакции между газами являются обратимыми. Классическим примером является синтез аммиака из азота и водорода (процесс Габера-Боша): $N_2(г) + 3H_2(г) \rightleftharpoons 2NH_3(г)$. Эта реакция протекает в обоих направлениях и достигает состояния равновесия.
Ответ: утверждение неверно.
б) обратимыми могут быть гетерогенные реакции;
Утверждение верно. Гетерогенные реакции — это реакции, в которых реагенты и продукты находятся в разных фазах (агрегатных состояниях). Такие реакции могут быть обратимыми. Например, термическое разложение карбоната кальция: $CaCO_3(тв) \rightleftharpoons CaO(тв) + CO_2(г)$. В замкнутой системе устанавливается равновесие между твердыми веществами и газообразным диоксидом углерода.
Ответ: утверждение верно.
в) в состоянии химического равновесия концентрации реагентов и продуктов равны;
Утверждение неверно. В состоянии химического равновесия скорости прямой ($v_{прям}$) и обратной ($v_{обр}$) реакций становятся равными ($v_{прям} = v_{обр}$), а концентрации всех участвующих веществ становятся постоянными. Однако сами концентрации реагентов и продуктов, как правило, не равны друг другу. Их соотношение определяется константой равновесия $K_c$.
Ответ: утверждение неверно.
г) любое внешнее воздействие влияет на положение равновесия (т. е. равновесные концентрации всех веществ);
Утверждение неверно. Не любое внешнее воздействие смещает равновесие. Например:
- Изменение давления не влияет на равновесие в реакциях, протекающих без изменения числа молей газообразных веществ (например, $H_2(г) + I_2(г) \rightleftharpoons 2HI(г)$).
- Добавление катализатора ускоряет как прямую, так и обратную реакции в одинаковой степени, поэтому он лишь ускоряет достижение равновесия, но не смещает его положение.
- Добавление инертного газа при постоянном объеме не изменяет парциальные давления реагентов и продуктов и не смещает равновесие.
Ответ: утверждение неверно.
д) если равновесие достигается с участием только твёрдых реагентов и продуктов, то давление не оказывает влияния на состояние равновесия;
Утверждение верно. Давление существенно влияет на концентрацию (или парциальное давление) газов. Объемы твердых веществ практически не изменяются при изменении давления, поэтому их концентрации (а точнее, активности) условно принимаются постоянными и равными единице. Следовательно, изменение давления не будет смещать равновесие в системе, состоящей только из твердых фаз.
Ответ: утверждение верно.
е) если систему, находящуюся в равновесии, нагреть (охладить), то она переходит в новое состояние равновесия;
Утверждение верно. Согласно принципу Ле Шателье, при изменении температуры равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому изменению. Нагревание смещает равновесие в сторону эндотермической реакции (поглощение тепла), а охлаждение — в сторону экзотермической (выделение тепла). В результате система приходит в новое равновесное состояние с новыми равновесными концентрациями и новым значением константы равновесия.
Ответ: утверждение верно.
ж) в равновесной системе в ответ на повышение давления происходит уменьшение числа газообразных частиц;
Утверждение верно. Это прямое следствие принципа Ле Шателье. Повышение давления (например, за счет уменьшения объема системы) создает "напряжение", которое система стремится ослабить. Ослабить это давление можно, уменьшив общее количество частиц газа. Поэтому равновесие смещается в сторону реакции, ведущей к уменьшению числа молей газообразных веществ.
Ответ: утверждение верно.
з) повышение температуры ускоряет как прямую, так и обратную реакции, но в разной степени;
Утверждение верно. Согласно уравнению Аррениуса, скорость любой химической реакции возрастает с повышением температуры. Это относится и к прямой, и к обратной реакции. Однако, поскольку энергии активации прямой и обратной реакций, как правило, различны, то и степень их ускорения при изменении температуры будет разной. Именно эта разница в ускорении и приводит к смещению химического равновесия.
Ответ: утверждение верно.
и) при добавлении в равновесную систему реагентов или продуктов их равновесные концентрации не изменяются.
Утверждение неверно. При добавлении в равновесную систему одного из реагентов или продуктов равновесие нарушается. Согласно принципу Ле Шателье, система будет стремиться противодействовать этому изменению: при добавлении реагента равновесие сместится в сторону продуктов, а при добавлении продукта — в сторону реагентов. В итоге установится новое состояние равновесия, в котором концентрации всех веществ будут отличаться от первоначальных.
Ответ: утверждение неверно.
Таким образом, верными являются утверждения: б, д, е, ж, з.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 578 расположенного на странице 95 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №578 (с. 95), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














