Номер 597, страница 99 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 22. Химическое равновесие - номер 597, страница 99.
№597 (с. 99)
Условие. №597 (с. 99)
скриншот условия

597. Реакция получения аммиака из водорода
$N_2 + 3H_2 \rightleftharpoons 2NH_3 + 92 \text{ кДж}$
является обратимой и экзотермической.
a) Определите, какое количество теплоты выделится при получении 986 кг аммиака?
б) Рассчитайте исходные химические количества веществ, если равновесные химические количества аммиака, водорода и азота соответственно равны 5, 1 и 1 моль.
Решение. №597 (с. 99)
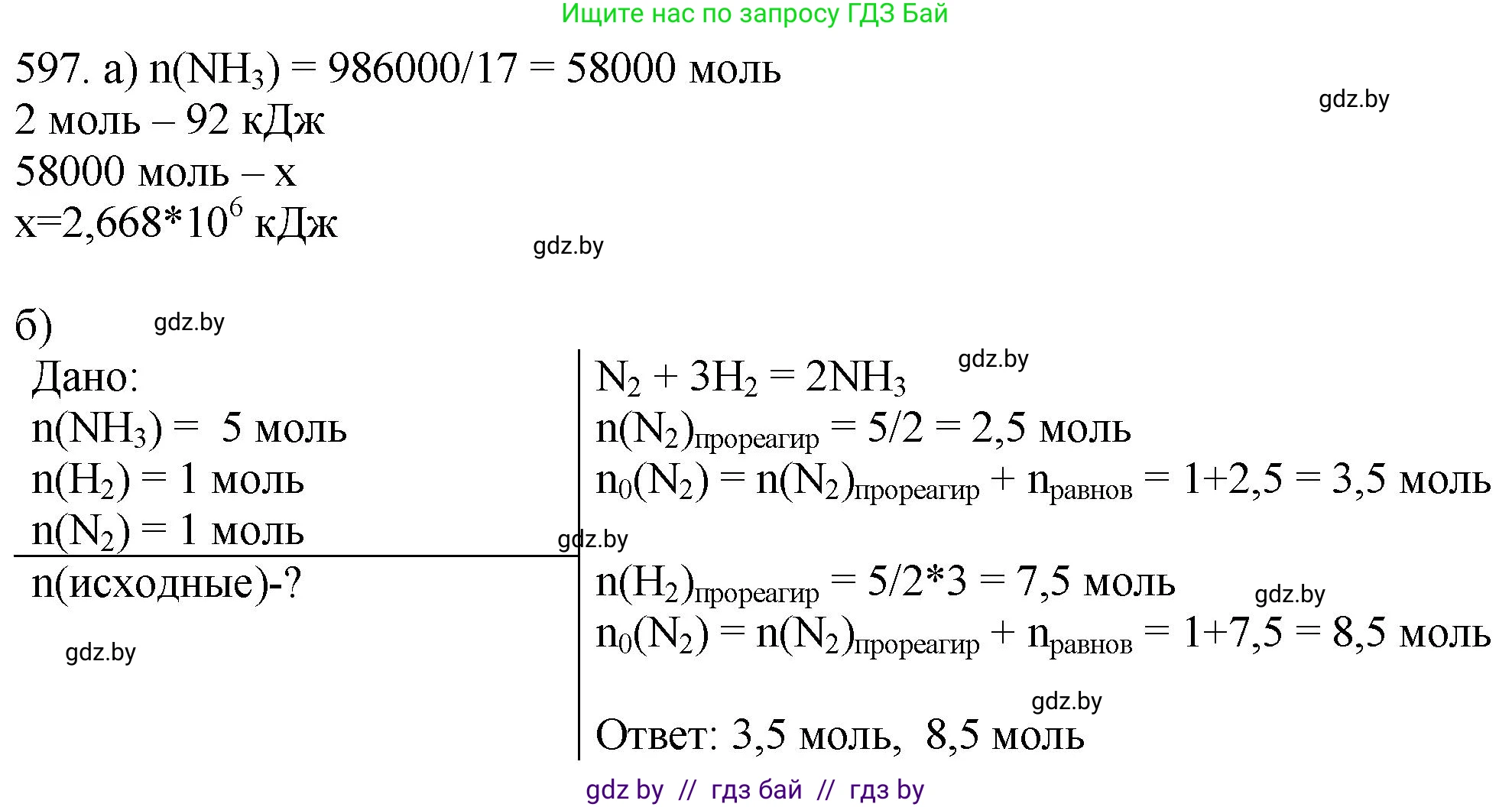
Решение 3. №597 (с. 99)
а)Дано:
Реакция: $N_2 + 3H_2 \rightleftharpoons 2NH_3 + 92 \text{ кДж}$
Масса аммиака: $m(NH_3) = 986 \text{ кг}$
Перевод в СИ:
$m(NH_3) = 986 \text{ кг} = 986000 \text{ г}$
Найти:
$Q$ — количество выделившейся теплоты
Решение:
1. Найдем молярную массу аммиака ($NH_3$). Она складывается из атомных масс азота (≈14 г/моль) и трех атомов водорода (≈1 г/моль):
$M(NH_3) = 14 + 3 \cdot 1 = 17 \text{ г/моль}$.
2. Рассчитаем химическое количество аммиака в 986 кг, используя формулу $n = m/M$:
$n(NH_3) = \frac{m(NH_3)}{M(NH_3)} = \frac{986000 \text{ г}}{17 \text{ г/моль}} = 58000 \text{ моль}$.
3. Из термохимического уравнения известно, что при образовании 2 моль $NH_3$ выделяется 92 кДж теплоты. Составим пропорцию для нахождения количества теплоты ($Q$), которое выделится при образовании 58000 моль $NH_3$:
2 моль $NH_3$ → 92 кДж
58000 моль $NH_3$ → $Q$ кДж
Решим пропорцию:
$Q = \frac{58000 \text{ моль} \cdot 92 \text{ кДж}}{2 \text{ моль}} = 29000 \cdot 92 \text{ кДж} = 2668000 \text{ кДж}$.
Это количество теплоты также можно выразить в мегаджоулях:
$2668000 \text{ кДж} = 2668 \text{ МДж}$.
Ответ: при получении 986 кг аммиака выделится 2668000 кДж (или 2668 МДж) теплоты.
б)Дано:
Равновесное количество аммиака: $n_{равн}(NH_3) = 5 \text{ моль}$
Равновесное количество водорода: $n_{равн}(H_2) = 1 \text{ моль}$
Равновесное количество азота: $n_{равн}(N_2) = 1 \text{ моль}$
Найти:
$n_{исх}(N_2)$ — исходное количество азота
$n_{исх}(H_2)$ — исходное количество водорода
Решение:
Уравнение реакции: $N_2 + 3H_2 \rightleftharpoons 2NH_3$.
1. Для нахождения исходных количеств реагентов нужно знать, сколько вещества прореагировало и сколько осталось в равновесии. Количество оставшихся веществ дано в условии. Рассчитаем, сколько веществ прореагировало.
2. Расчет будем вести по продукту реакции — аммиаку. Предполагается, что в начальный момент реакции аммиак отсутствовал ($n_{исх}(NH_3) = 0$). Следовательно, количество образовавшегося аммиака равно его равновесному количеству: $n_{обр}(NH_3) = 5 \text{ моль}$.
3. Используя стехиометрические коэффициенты из уравнения реакции (1:3:2), найдем, сколько моль азота и водорода было израсходовано ($n_{реаг}$) на образование 5 моль аммиака.
Количество израсходованного азота:
$n_{реаг}(N_2) = n_{обр}(NH_3) \cdot \frac{1}{2} = 5 \text{ моль} \cdot 0.5 = 2.5 \text{ моль}$.
Количество израсходованного водорода:
$n_{реаг}(H_2) = n_{обр}(NH_3) \cdot \frac{3}{2} = 5 \text{ моль} \cdot 1.5 = 7.5 \text{ моль}$.
4. Исходное количество каждого реагента ($n_{исх}$) равно сумме количества, вступившего в реакцию ($n_{реаг}$), и равновесного (оставшегося) количества ($n_{равн}$):
$n_{исх} = n_{реаг} + n_{равн}$
Исходное количество азота:
$n_{исх}(N_2) = n_{реаг}(N_2) + n_{равн}(N_2) = 2.5 \text{ моль} + 1 \text{ моль} = 3.5 \text{ моль}$.
Исходное количество водорода:
$n_{исх}(H_2) = n_{реаг}(H_2) + n_{равн}(H_2) = 7.5 \text{ моль} + 1 \text{ моль} = 8.5 \text{ моль}$.
Ответ: исходное химическое количество азота составляло 3.5 моль, а исходное химическое количество водорода — 8.5 моль.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 597 расположенного на странице 99 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №597 (с. 99), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














