Номер 573, страница 105 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 36. Кремний — химический элемент и простое вещество - номер 573, страница 105.
№573 (с. 105)
Условие. №573 (с. 105)
скриншот условия

573. Определите степень окисления атомов кремния в
следующих соединениях:
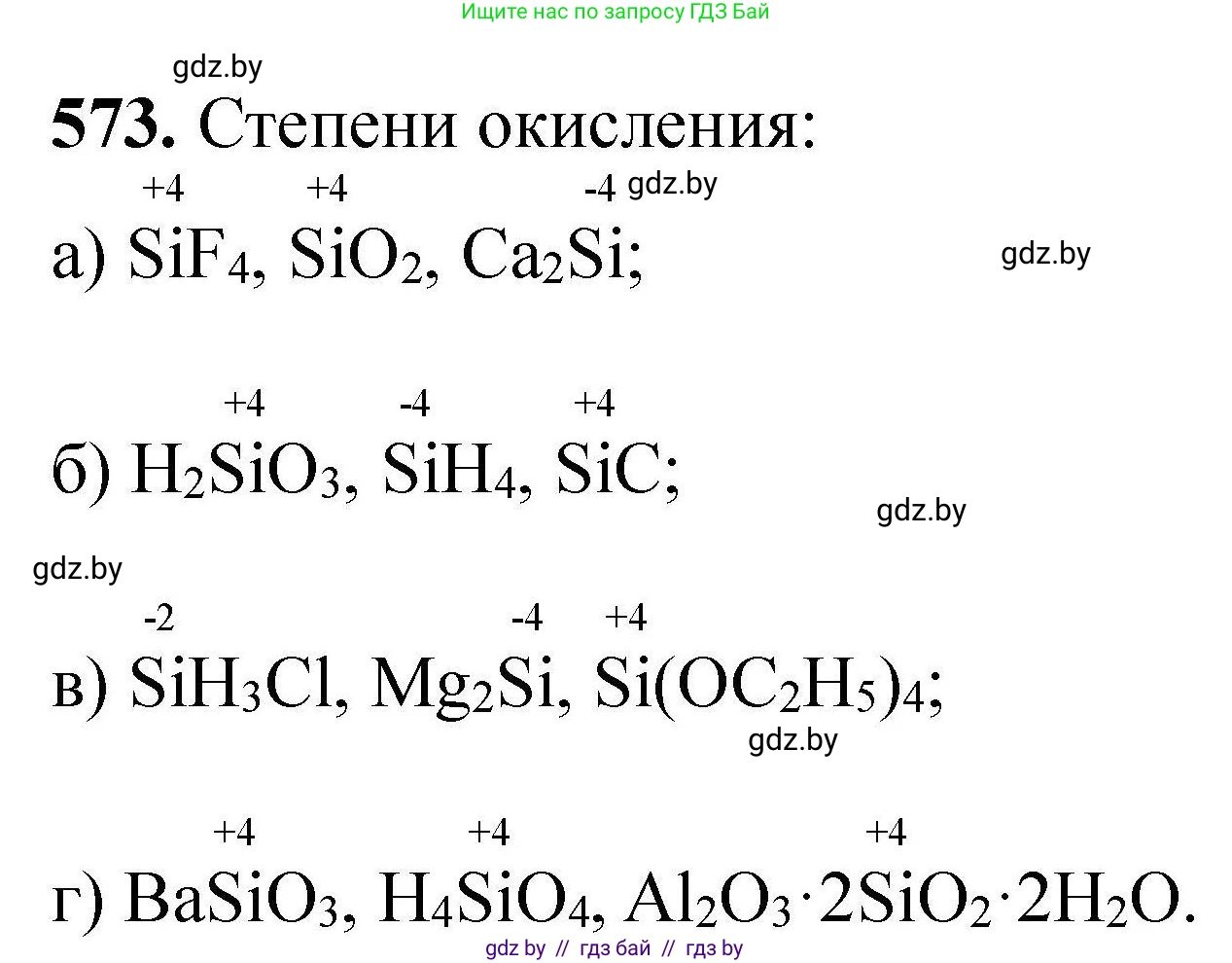
а) $SiF_4$, $SiO_2$, $Ca_2Si$;
б) $H_2SiO_3$, $SiH_4$, $SiC$;
в) $SiH_3Cl$, $Mg_2Si$, $Si(OC_2H_5)_4$;
г) $BaSiO_3$, $H_4SiO_4$, $Al_2O_3 \cdot 2SiO_2 \cdot 2H_2O$.
Решение. №573 (с. 105)
Решение 2. №573 (с. 105)
а) SiF₄, SiO₂, Ca₂Si;
Для определения степени окисления кремния (Si) в соединениях, обозначив её как $x$, будем использовать правило электронейтральности молекулы: сумма степеней окисления всех атомов в молекуле равна нулю. Также учтем постоянные степени окисления некоторых элементов:
- Степень окисления фтора (F) в соединениях всегда равна -1.
- Степень окисления кислорода (O) в оксидах и большинстве других соединений равна -2.
- Степень окисления щелочноземельных металлов (например, кальция Ca) в соединениях равна +2.
В соединении SiF₄ (тетрафторид кремния):
В молекуле один атом кремния и четыре атома фтора. Степень окисления фтора равна -1.
Составим уравнение: $x + 4 \cdot (-1) = 0$.
$x - 4 = 0$.
$x = +4$.
В соединении SiO₂ (диоксид кремния):
В молекуле один атом кремния и два атома кислорода. Степень окисления кислорода равна -2.
Составим уравнение: $x + 2 \cdot (-2) = 0$.
$x - 4 = 0$.
$x = +4$.
В соединении Ca₂Si (силицид кальция):
В молекуле два атома кальция и один атом кремния. Степень окисления кальция равна +2.
Составим уравнение: $2 \cdot (+2) + x = 0$.
$4 + x = 0$.
$x = -4$.
Ответ: в SiF₄ степень окисления Si равна +4; в SiO₂ степень окисления Si равна +4; в Ca₂Si степень окисления Si равна -4.
б) H₂SiO₃, SiH₄, SiC;
Для этих соединений используем дополнительные правила:
- Степень окисления водорода (H) в соединениях с неметаллами принимается равной +1.
- В бинарных соединениях неметаллов (как SiC) отрицательную степень окисления проявляет более электроотрицательный элемент. Углерод (C) более электроотрицателен, чем кремний (Si), и его типичная отрицательная степень окисления -4.
В соединении H₂SiO₃ (кремниевая кислота):
Степень окисления водорода (H) равна +1, кислорода (O) равна -2.
Составим уравнение: $2 \cdot (+1) + x + 3 \cdot (-2) = 0$.
$2 + x - 6 = 0$.
$x - 4 = 0$.
$x = +4$.
В соединении SiH₄ (силан):
Степень окисления водорода (H) в соединении с кремнием равна +1.
Составим уравнение: $x + 4 \cdot (+1) = 0$.
$x + 4 = 0$.
$x = -4$.
В соединении SiC (карбид кремния):
Углерод (C) как более электроотрицательный элемент имеет степень окисления -4.
Составим уравнение: $x + (-4) = 0$.
$x = +4$.
Ответ: в H₂SiO₃ степень окисления Si равна +4; в SiH₄ степень окисления Si равна -4; в SiC степень окисления Si равна +4.
в) SiH₃Cl, Mg₂Si, Si(OC₂H₅)₄;
Применяем уже известные правила, а также:
- Степень окисления хлора (Cl), как более электроотрицательного элемента, чем Si и H, равна -1.
- Степень окисления магния (Mg) как щелочноземельного металла равна +2.
- В сложных органических соединениях, таких как эфиры, можно рассматривать кислотные остатки как ионы. Группа OC₂H₅ (этокси-группа) является остатком спирта C₂H₅OH и имеет заряд -1.
В соединении SiH₃Cl (хлорсилан):
Степень окисления водорода (H) равна +1, хлора (Cl) равна -1.
Составим уравнение: $x + 3 \cdot (+1) + (-1) = 0$.
$x + 3 - 1 = 0$.
$x + 2 = 0$.
$x = -2$.
В соединении Mg₂Si (силицид магния):
Степень окисления магния (Mg) равна +2.
Составим уравнение: $2 \cdot (+2) + x = 0$.
$4 + x = 0$.
$x = -4$.
В соединении Si(OC₂H₅)₄ (тетраэтоксисилан):
Этокси-группа (OC₂H₅) имеет условный заряд -1. В молекуле 4 таких группы.
Составим уравнение: $x + 4 \cdot (-1) = 0$.
$x - 4 = 0$.
$x = +4$.
Ответ: в SiH₃Cl степень окисления Si равна -2; в Mg₂Si степень окисления Si равна -4; в Si(OC₂H₅)₄ степень окисления Si равна +4.
г) BaSiO₃, H₄SiO₄, Al₂O₃·2SiO₂·2H₂O.
Используем ранее упомянутые правила. В формуле кристаллогидрата Al₂O₃·2SiO₂·2H₂O степени окисления определяются для каждого оксида отдельно.
- Степень окисления бария (Ba) как щелочноземельного металла равна +2.
- Степень окисления алюминия (Al) в соединениях, как правило, равна +3.
В соединении BaSiO₃ (силикат бария):
Степень окисления бария (Ba) равна +2, кислорода (O) равна -2.
Составим уравнение: $(+2) + x + 3 \cdot (-2) = 0$.
$2 + x - 6 = 0$.
$x - 4 = 0$.
$x = +4$.
В соединении H₄SiO₄ (ортокремниевая кислота):
Степень окисления водорода (H) равна +1, кислорода (O) равна -2.
Составим уравнение: $4 \cdot (+1) + x + 4 \cdot (-2) = 0$.
$4 + x - 8 = 0$.
$x - 4 = 0$.
$x = +4$.
В соединении Al₂O₃·2SiO₂·2H₂O (каолинит):
Формула представляет собой смешанное соединение (кристаллогидрат), состоящее из оксида алюминия, оксида кремния и воды. Степень окисления кремния определяется из его оксида, SiO₂.
В части SiO₂: степень окисления кислорода (O) равна -2.
Составим уравнение для SiO₂: $x + 2 \cdot (-2) = 0$.
$x - 4 = 0$.
$x = +4$.
Ответ: в BaSiO₃ степень окисления Si равна +4; в H₄SiO₄ степень окисления Si равна +4; в Al₂O₃·2SiO₂·2H₂O степень окисления Si равна +4.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 573 расположенного на странице 105 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №573 (с. 105), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














