Номер 682, страница 124 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 4. Металлы. Параграф 43. Ряд активности металлов. Взаимодействие металлов с растворами кислот - номер 682, страница 124.
№682 (с. 124)
Условие. №682 (с. 124)
скриншот условия

682. Составьте молекулярные уравнения между указанными веществами и для каждой пары укажите окислитель и восстановитель:
а) цинк и соляная кислота;
б) железо и кислород;
в) серная кислота и алюминий;
г) натрий и вода.
Решение. №682 (с. 124)

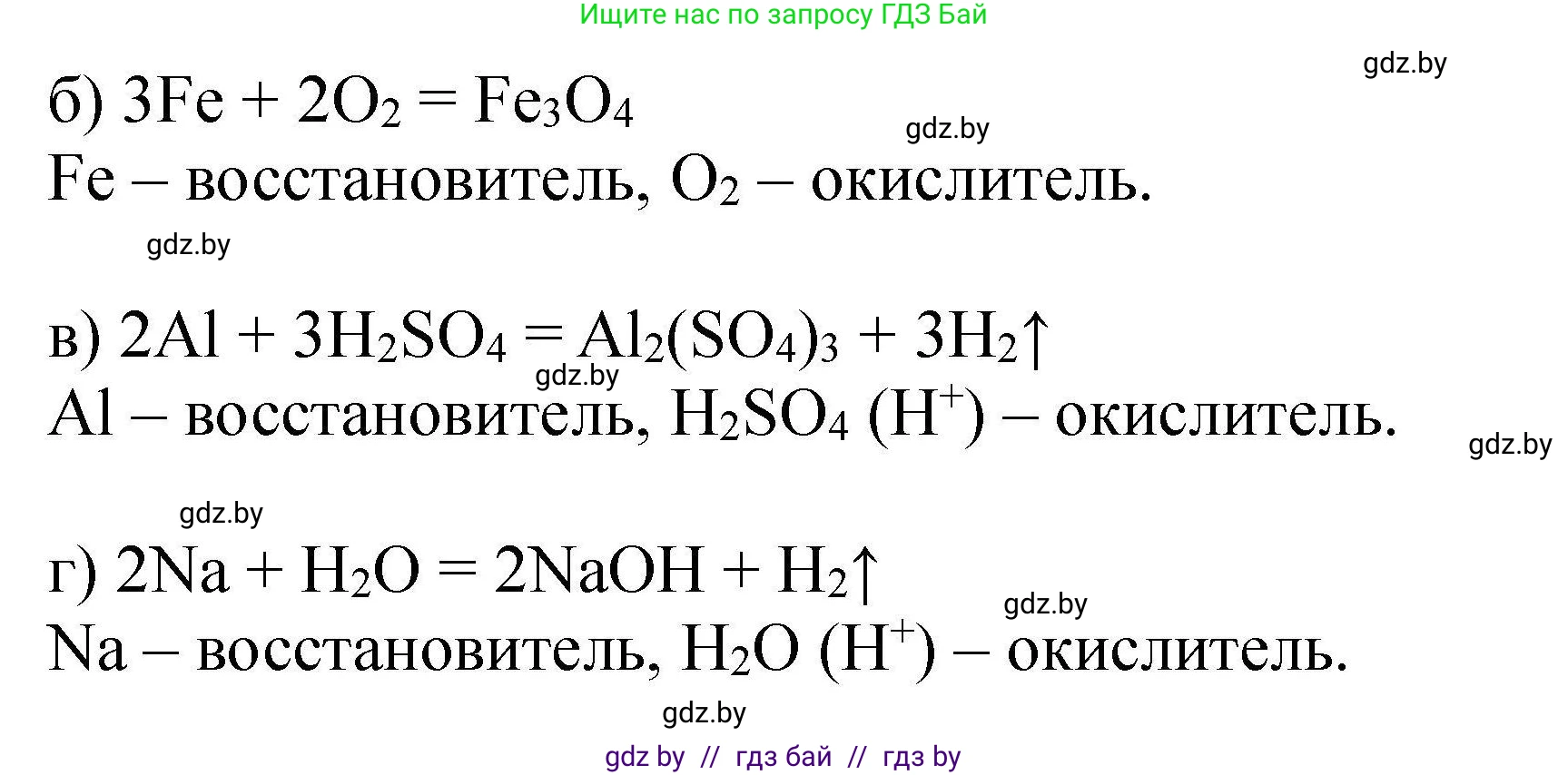
Решение 2. №682 (с. 124)
а) цинк и соляная кислота;
Цинк, как металл, стоящий в ряду активности металлов левее водорода, реагирует с соляной кислотой с образованием соли (хлорида цинка) и выделением водорода. Молекулярное уравнение реакции:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
Чтобы определить окислитель и восстановитель, рассмотрим изменение степеней окисления элементов:
$ \stackrel{0}{Zn} + 2\stackrel{+1}{H}\stackrel{-1}{Cl} \rightarrow \stackrel{+2}{Zn}\stackrel{-1}{Cl}_2 + \stackrel{0}{H}_2 \uparrow $
Цинк ($Zn$) повышает свою степень окисления с 0 до +2, отдавая 2 электрона ($Zn^0 - 2e^- \rightarrow Zn^{+2}$). Процесс отдачи электронов — окисление. Вещество, которое окисляется, является восстановителем.
Водород ($H$) в соляной кислоте понижает свою степень окисления с +1 до 0, принимая 1 электрон ($2H^{+1} + 2e^- \rightarrow H_2^0$). Процесс присоединения электронов — восстановление. Вещество (или ион в его составе), которое восстанавливается, является окислителем.
Ответ: восстановитель — цинк ($Zn$), окислитель — соляная кислота ($HCl$), за счет ионов водорода $H^+$.
б) железо и кислород;
Железо реагирует с кислородом (особенно при нагревании), образуя оксид. Одним из продуктов является оксид железа(III). Молекулярное уравнение реакции:
$4Fe + 3O_2 \rightarrow 2Fe_2O_3$
Рассмотрим изменение степеней окисления:
$ 4\stackrel{0}{Fe} + 3\stackrel{0}{O}_2 \rightarrow 2\stackrel{+3}{Fe}_2\stackrel{-2}{O}_3 $
Железо ($Fe$) повышает степень окисления с 0 до +3, отдавая электроны ($Fe^0 - 3e^- \rightarrow Fe^{+3}$). Следовательно, железо окисляется и является восстановителем.
Кислород ($O$) понижает степень окисления с 0 до -2, принимая электроны ($O_2^0 + 4e^- \rightarrow 2O^{-2}$). Следовательно, кислород восстанавливается и является окислителем.
Ответ: восстановитель — железо ($Fe$), окислитель — кислород ($O_2$).
в) серная кислота и алюминий;
Алюминий, как активный металл, реагирует с разбавленной серной кислотой с образованием сульфата алюминия и выделением водорода. Молекулярное уравнение реакции:
$2Al + 3H_2SO_4 (\text{разб.}) \rightarrow Al_2(SO_4)_3 + 3H_2 \uparrow$
Рассмотрим изменение степеней окисления:
$ 2\stackrel{0}{Al} + 3\stackrel{+1}{H}_2SO_4 \rightarrow \stackrel{+3}{Al}_2(SO_4)_3 + 3\stackrel{0}{H}_2 \uparrow $
Алюминий ($Al$) повышает свою степень окисления с 0 до +3 ($Al^0 - 3e^- \rightarrow Al^{+3}$), он является восстановителем.
Водород ($H$) в серной кислоте понижает свою степень окисления с +1 до 0 ($2H^{+1} + 2e^- \rightarrow H_2^0$), следовательно, серная кислота за счет ионов водорода $H^+$ является окислителем. Степень окисления серы (+6) и кислорода (-2) в сульфат-ионе не изменяется.
Ответ: восстановитель — алюминий ($Al$), окислитель — серная кислота ($H_2SO_4$).
г) натрий и вода.
Натрий — щелочной металл, бурно реагирующий с водой с образованием щелочи (гидроксида натрия) и водорода. Молекулярное уравнение реакции:
$2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow$
Рассмотрим изменение степеней окисления:
$ 2\stackrel{0}{Na} + 2\stackrel{+1}{H}_2\stackrel{-2}{O} \rightarrow 2\stackrel{+1}{Na}\stackrel{-2}{O}\stackrel{+1}{H} + \stackrel{0}{H}_2 \uparrow $
Натрий ($Na$) повышает степень окисления с 0 до +1 ($Na^0 - 1e^- \rightarrow Na^{+1}$), он окисляется и является восстановителем.
Водород ($H$) в составе воды понижает свою степень окисления с +1 до 0 ($2H^{+1} + 2e^- \rightarrow H_2^0$), принимая электроны. Следовательно, вода (за счет атома водорода) восстанавливается и является окислителем.
Ответ: восстановитель — натрий ($Na$), окислитель — вода ($H_2O$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 682 расположенного на странице 124 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №682 (с. 124), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














