Номер 504, страница 77 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 18. Классификация и общие характеристики химических реакций. 1. *Окислительно-восстановительные реакции - номер 504, страница 77.
№504 (с. 77)
Условие. №504 (с. 77)
скриншот условия

504. *Укажите верные утверждения:
а) за счёт атомов кислорода пероксид водорода может быть в химических реакциях только окислителем;
б) при растворении цинка в соляной кислоте окислителем являются хлорид-ионы;
в) разбавленный водный раствор серной кислоты является окислителем за счёт ионов водорода;
г) соединения, содержащие атомы галогенов в положительных степенях окисления, часто проявляют сильные окислительные свойства;
д) в химических реакциях цинк всегда выступает в качестве восстановителя, а серебро — в качестве окислителя;
е) железо является и окислителем, и восстановителем в реакции между железом и хлоридом железа(III);
ж) вода в химических реакциях может выступать и окислителем, и восстановителем.
Решение. №504 (с. 77)
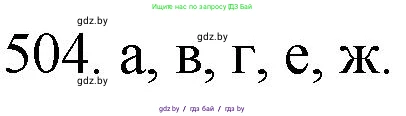
Решение 3. №504 (с. 77)
а) за счёт атомов кислорода пероксид водорода может быть в химических реакциях только окислителем;
Это утверждение неверно. В пероксиде водорода ($H_2O_2$) кислород имеет промежуточную степень окисления -1. Атомы кислорода могут как принимать электроны, понижая степень окисления до -2 (проявляя свойства окислителя), так и отдавать электроны, повышая степень окисления до 0 (проявляя свойства восстановителя).
Пример, где $H_2O_2$ — окислитель (степень окисления кислорода понижается с -1 до -2):
$2KI + H_2O_2 + H_2SO_4 \rightarrow I_2 + K_2SO_4 + 2H_2O$
Пример, где $H_2O_2$ — восстановитель (степень окисления кислорода повышается с -1 до 0):
$2KMnO_4 + 5H_2O_2 + 3H_2SO_4 \rightarrow 2MnSO_4 + K_2SO_4 + 5O_2 + 8H_2O$
Ответ: Неверно.
б) при растворении цинка в соляной кислоте окислителем являются хлорид-ионы;
Это утверждение неверно. Уравнение реакции: $Zn + 2HCl \rightarrow ZnCl_2 + H_2$.
Рассмотрим изменение степеней окисления:
$Zn^0 - 2e^- \rightarrow Zn^{+2}$ (цинк окисляется, он — восстановитель).
$2H^{+1} + 2e^- \rightarrow H_2^0$ (водород восстанавливается, ионы $H^+$ — окислитель).
Степень окисления хлорид-ионов ($Cl^{-1}$) в ходе реакции не изменяется. Окислителем являются катионы водорода.
Ответ: Неверно.
в) разбавленный водный раствор серной кислоты является окислителем за счёт ионов водорода;
Это утверждение верно. В реакциях разбавленной серной кислоты с металлами, стоящими в ряду активности до водорода, окислителем выступают именно ионы водорода $H^+$, которые восстанавливаются до молекулярного водорода $H_2$. Атом серы в сульфат-ионе ($SO_4^{2-}$) свою степень окисления +6 не меняет.
Пример: $Fe + H_2SO_4(разб.) \rightarrow FeSO_4 + H_2$.
$2H^{+1} + 2e^- \rightarrow H_2^0$.
Ответ: Верно.
г) соединения, содержащие атомы галогенов в положительных степенях окисления, часто проявляют сильные окислительные свойства;
Это утверждение верно. Галогены — сильные неметаллы, для них наиболее характерна и устойчива степень окисления -1. Находясь в положительной степени окисления (например, $Cl^{+1}$ в $HClO$, $Cl^{+5}$ в $KClO_3$, $Cl^{+7}$ в $HClO_4$), атомы галогенов стремятся принять электроны и перейти в более устойчивую низшую степень окисления. Это стремление принять электроны и определяет их сильные окислительные свойства.
Ответ: Верно.
д) в химических реакциях цинк всегда выступает в качестве восстановителя, а серебро — в качестве окислителя;
Это утверждение неверно. Цинк, как активный металл, в реакциях действительно всегда отдает электроны, переходя из степени окисления 0 в +2, то есть всегда является восстановителем. Однако серебро ($Ag$) как простое вещество также является металлом и в реакциях отдает электрон, переходя из степени окисления 0 в +1, то есть выступает восстановителем (например, в реакции с концентрированной азотной кислотой). Окислителем может быть только ион серебра $Ag^+$, который принимает электрон и восстанавливается до металлического серебра $Ag^0$. Таким образом, утверждение, что серебро *всегда* является окислителем, неверно.
Ответ: Неверно.
е) железо является и окислителем, и восстановителем в реакции между железом и хлоридом железа(III);
Это утверждение верно. В данной реакции, называемой реакцией конпропорционирования, взаимодействуют простое вещество железо ($Fe^0$) и ионы железа($III$) ($Fe^{+3}$).
Уравнение реакции: $Fe + 2FeCl_3 \rightarrow 3FeCl_2$.
$Fe^0 - 2e^- \rightarrow Fe^{+2}$ (железо в степени окисления 0 окисляется, является восстановителем).
$Fe^{+3} + 1e^- \rightarrow Fe^{+2}$ (железо в степени окисления +3 восстанавливается, является окислителем).
Таким образом, в рамках одной реакции элемент железо выступает и в роли окислителя (в виде $Fe^{+3}$), и в роли восстановителя (в виде $Fe^0$).
Ответ: Верно.
ж) вода в химических реакциях может выступать и окислителем, и восстановителем.
Это утверждение верно. Вода проявляет окислительно-восстановительную двойственность.
Вода — окислитель (за счет водорода в степени окисления +1, который восстанавливается до 0) в реакциях с активными металлами:
$2Na + 2H_2O \rightarrow 2NaOH + H_2$.
Вода — восстановитель (за счет кислорода в степени окисления -2, который окисляется до 0) в реакциях с очень сильными окислителями, например, с фтором:
$2F_2 + 2H_2O \rightarrow 4HF + O_2$.
Ответ: Верно.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 504 расположенного на странице 77 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №504 (с. 77), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














