Номер 505, страница 77 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 18. Классификация и общие характеристики химических реакций. 1. *Окислительно-восстановительные реакции - номер 505, страница 77.
№505 (с. 77)
Условие. №505 (с. 77)
скриншот условия

505. *Предложите продукты, которые могут образоваться при взаимодействии указанных реагентов, и составьте уравнения соответствующих реакций:
а) $Fe(OH)_2 + O_2 + H_2O \rightarrow$;
б) $H_2SO_3 + H_2O_2 \rightarrow$;
в) $KMnO_4 + SO_2 + H_2SO_4 \rightarrow$;
г) $Cu + HNO_3 \rightarrow$;
д) $H_2S + SO_2 \rightarrow$;
е) $Cu_2S + HNO_3 \rightarrow$;
ж) $Fe(NO_3)_2 + HNO_3 \rightarrow$;
з) $Cl_2 + Ba(OH)_2 \rightarrow$.
Решение. №505 (с. 77)
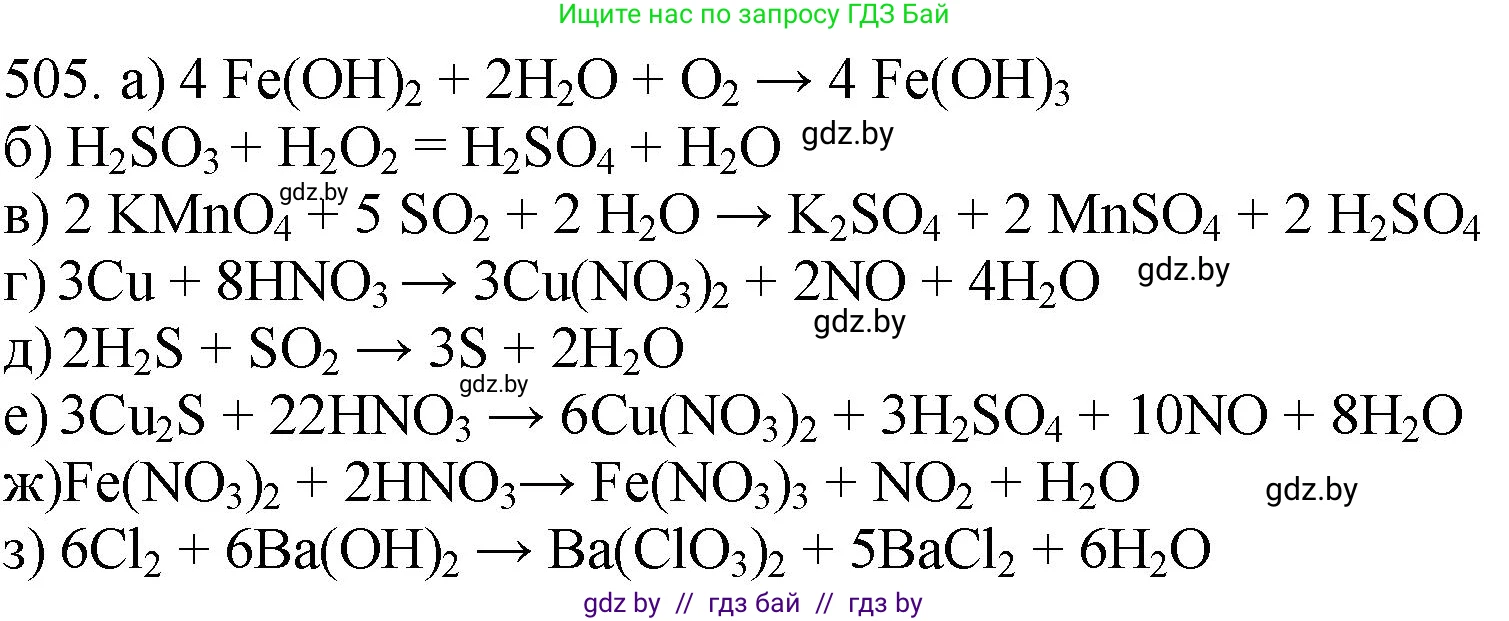
Решение 3. №505 (с. 77)
а) При взаимодействии гидроксида железа(II) с кислородом в присутствии воды происходит окислительно-восстановительная реакция. Железо в степени окисления +2 окисляется до степени окисления +3, а кислород восстанавливается. Гидроксид железа(II) $Fe(OH)_2$ (белый или зеленоватый осадок) превращается в гидроксид железа(III) $Fe(OH)_3$ (бурый осадок).
Уравнение реакции: $4Fe(OH)_2 + O_2 + 2H_2O \rightarrow 4Fe(OH)_3 \downarrow$
Электронный баланс: $Fe^{+2} - 1e^- \rightarrow Fe^{+3} \quad | \ 4$ (окисление) $O_2^0 + 4e^- \rightarrow 2O^{-2} \quad | \ 1$ (восстановление)
Ответ: $4Fe(OH)_2 + O_2 + 2H_2O \rightarrow 4Fe(OH)_3$.
б) Сернистая кислота ($H_2SO_3$) является восстановителем, а пероксид водорода ($H_2O_2$) — сильным окислителем. В ходе реакции сера в степени окисления +4 (в $H_2SO_3$) окисляется до своей высшей степени окисления +6, образуя серную кислоту ($H_2SO_4$). Кислород в пероксиде водорода (степень окисления -1) восстанавливается до -2, образуя воду.
Уравнение реакции: $H_2SO_3 + H_2O_2 \rightarrow H_2SO_4 + H_2O$
Электронный баланс: $S^{+4} - 2e^- \rightarrow S^{+6} \quad | \ 1$ (окисление) $2O^{-1} + 2e^- \rightarrow 2O^{-2} \quad | \ 1$ (восстановление)
Ответ: $H_2SO_3 + H_2O_2 \rightarrow H_2SO_4 + H_2O$.
в) Это классическая окислительно-восстановительная реакция в кислой среде. Перманганат калия ($KMnO_4$) — сильный окислитель (марганец в степени окисления +7). Диоксид серы ($SO_2$) — восстановитель (сера в степени окисления +4). Серная кислота ($H_2SO_4$) создает кислую среду. В кислой среде $Mn^{+7}$ восстанавливается до $Mn^{+2}$, а $S^{+4}$ окисляется до $S^{+6}$.
Продуктами реакции являются сульфат марганца(II), сульфат калия и вода.
Электронный баланс: $Mn^{+7} + 5e^- \rightarrow Mn^{+2} \quad | \ 2$ (восстановление) $S^{+4} - 2e^- \rightarrow S^{+6} \quad | \ 5$ (окисление)
Уравнение реакции: $2KMnO_4 + 5SO_2 + 2H_2O \rightarrow 2MnSO_4 + K_2SO_4 + 2H_2SO_4$
Примечание: В данном случае серная кислота является не только средой, но и продуктом реакции, так как окисленная сера из $SO_2$ также образует серную кислоту. Указание $H_2SO_4$ в реагентах подчеркивает, что реакция протекает в кислой среде.
Ответ: $2KMnO_4 + 5SO_2 + 2H_2O \rightarrow 2MnSO_4 + K_2SO_4 + 2H_2SO_4$.
г) Результат взаимодействия меди с азотной кислотой зависит от концентрации кислоты. Азотная кислота является кислотой-окислителем и реагирует с медью, хотя медь стоит после водорода в ряду активности металлов.
1.При взаимодействии с концентрированной азотной кислотой ($HNO_3$): Медь окисляется до нитрата меди(II) ($Cu(NO_3)_2$), а азотная кислота восстанавливается до диоксида азота ($NO_2$), бурого газа.
$Cu^0 - 2e^- \rightarrow Cu^{+2} \quad | \ 1$
$N^{+5} + 1e^- \rightarrow N^{+4} \quad | \ 2$
Уравнение реакции: $Cu + 4HNO_3 (конц.) \rightarrow Cu(NO_3)_2 + 2NO_2 \uparrow + 2H_2O$
2.При взаимодействии с разбавленной азотной кислотой ($HNO_3$): Медь также окисляется до нитрата меди(II), но кислота восстанавливается глубже — до оксида азота(II) ($NO$), бесцветного газа.
$Cu^0 - 2e^- \rightarrow Cu^{+2} \quad | \ 3$
$N^{+5} + 3e^- \rightarrow N^{+2} \quad | \ 2$
Уравнение реакции: $3Cu + 8HNO_3 (разб.) \rightarrow 3Cu(NO_3)_2 + 2NO \uparrow + 4H_2O$
Ответ: В зависимости от концентрации кислоты возможны разные продукты.
С концентрированной кислотой: $Cu + 4HNO_3 \rightarrow Cu(NO_3)_2 + 2NO_2 + 2H_2O$.
С разбавленной кислотой: $3Cu + 8HNO_3 \rightarrow 3Cu(NO_3)_2 + 2NO + 4H_2O$.
д) Реакция между сероводородом ($H_2S$) и диоксидом серы ($SO_2$) является реакцией сопропорционирования. Сера в сероводороде имеет степень окисления -2 (восстановитель), а в диоксиде серы +4 (окислитель). Они реагируют с образованием простого вещества — серы ($S$), имеющей промежуточную степень окисления 0.
Электронный баланс: $S^{-2} - 2e^- \rightarrow S^0 \quad | \ 2$ (окисление) $S^{+4} + 4e^- \rightarrow S^0 \quad | \ 1$ (восстановление)
Уравнение реакции: $2H_2S + SO_2 \rightarrow 3S \downarrow + 2H_2O$
Ответ: $2H_2S + SO_2 \rightarrow 3S + 2H_2O$.
е) В реакции сульфида меди(I) ($Cu_2S$) с азотной кислотой происходит окисление обоих элементов, входящих в состав сульфида: и меди ($Cu^{+1}$), и серы ($S^{-2}$). Продукты реакции зависят от условий (концентрации кислоты, температуры). При действии концентрированной азотной кислоты медь окисляется до $Cu^{+2}$, а сера — до $S^{+6}$. Азот восстанавливается до $NO_2$.
Электронный баланс: $Cu_2S - 10e^- \rightarrow 2Cu^{+2} + S^{+6} \quad | \ 1$ (окисление: $2Cu^{+1} \rightarrow 2Cu^{+2} + 2e^-$ и $S^{-2} \rightarrow S^{+6} + 8e^-$)
$N^{+5} + 1e^- \rightarrow N^{+4} \quad | \ 10$ (восстановление)
Продуктами будут нитрат меди(II), серная кислота, диоксид азота и вода.
$Cu_2S + 14HNO_3 (конц.) \rightarrow 2Cu(NO_3)_2 + H_2SO_4 + 10NO_2 \uparrow + 6H_2O$
Ответ: $Cu_2S + 14HNO_3 \rightarrow 2Cu(NO_3)_2 + H_2SO_4 + 10NO_2 + 6H_2O$.
ж) Нитрат железа(II) ($Fe(NO_3)_2$) легко окисляется азотной кислотой до нитрата железа(III) ($Fe(NO_3)_3$). Железо повышает степень окисления с +2 до +3. Азотная кислота, являясь окислителем, восстанавливается, как правило, до оксида азота(II) ($NO$).
Электронный баланс: $Fe^{+2} - 1e^- \rightarrow Fe^{+3} \quad | \ 3$ (окисление) $N^{+5} + 3e^- \rightarrow N^{+2} \quad | \ 1$ (восстановление)
Уравнение реакции: $3Fe(NO_3)_2 + 4HNO_3 \rightarrow 3Fe(NO_3)_3 + NO \uparrow + 2H_2O$
Ответ: $3Fe(NO_3)_2 + 4HNO_3 \rightarrow 3Fe(NO_3)_3 + NO + 2H_2O$.
з) Взаимодействие хлора ($Cl_2$) с гидроксидом бария ($Ba(OH)_2$) является реакцией диспропорционирования, продукты которой зависят от температуры.
1.На холоде (в холодном растворе): Хлор диспропорционирует на хлорид-ион ($Cl^{-1}$) и гипохлорит-ион ($ClO^{-1}$).
Уравнение реакции: $2Cl_2 + 2Ba(OH)_2 (хол.) \rightarrow BaCl_2 + Ba(ClO)_2 + 2H_2O$
2.При нагревании (в горячем растворе): Происходит более глубокое диспропорционирование с образованием хлорид-иона ($Cl^{-1}$) и хлорат-иона ($ClO_3^{-1}$).
Электронный баланс: $Cl_2^0 + 2e^- \rightarrow 2Cl^{-1} \quad | \ 5$ (восстановление) $Cl_2^0 - 10e^- \rightarrow 2Cl^{+5} \quad | \ 1$ (окисление)
Уравнение реакции: $6Cl_2 + 6Ba(OH)_2 (гор.) \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + 6H_2O$
Ответ: Продукты зависят от температуры.
На холоде: $2Cl_2 + 2Ba(OH)_2 \rightarrow BaCl_2 + Ba(ClO)_2 + 2H_2O$.
При нагревании: $6Cl_2 + 6Ba(OH)_2 \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + 6H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 505 расположенного на странице 77 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №505 (с. 77), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














