Номер 517, страница 80 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 19. Тепловые эффекты химических реакций - номер 517, страница 80.
№517 (с. 80)
Условие. №517 (с. 80)
скриншот условия

517. При сгорании смеси водорода с кислородом объёмом (н. у.) 240 $\text{дм}^3$ выделился 1021 кДж теплоты. Составьте термохимическое уравнение протекающей реакции, если в сгоревшей смеси объёмная доля кислорода была в 2 раза больше объёмной доли водорода.
Решение. №517 (с. 80)
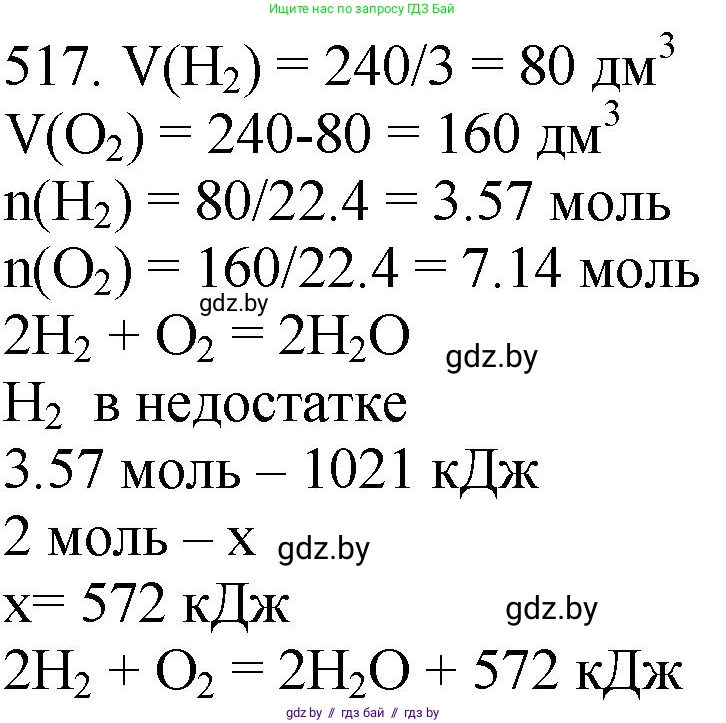
Решение 3. №517 (с. 80)
Дано:
$V(\text{смеси } H_2 \text{ и } O_2) = 240 \text{ дм}^3$ (н. у.)
$Q = 1021 \text{ кДж}$
$\phi(O_2) = 2 \cdot \phi(H_2)$
Перевод в систему СИ:
$V(\text{смеси } H_2 \text{ и } O_2) = 240 \text{ дм}^3 = 240 \cdot 10^{-3} \text{ м}^3 = 0.24 \text{ м}^3$
$Q = 1021 \text{ кДж} = 1021 \cdot 10^3 \text{ Дж} = 1021000 \text{ Дж}$
Найти:
Термохимическое уравнение протекающей реакции.
Решение:
1. Сначала запишем уравнение реакции горения водорода в кислороде:
$2H_{2(г)} + O_{2(г)} \rightarrow 2H_2O$
2. Определим объемы водорода и кислорода в исходной смеси. Общий объем смеси составляет $V_{\text{смеси}} = V(H_2) + V(O_2) = 240 \text{ дм}^3$.
Из условия задачи известно, что объемная доля кислорода в 2 раза больше объемной доли водорода: $\phi(O_2) = 2 \cdot \phi(H_2)$. Так как для газов объемные доли пропорциональны их объемам (при одинаковых условиях), то можно записать: $V(O_2) = 2 \cdot V(H_2)$.
Решим систему уравнений:
$V(H_2) + V(O_2) = 240$
$V(O_2) = 2 \cdot V(H_2)$
Подставим второе уравнение в первое:
$V(H_2) + 2 \cdot V(H_2) = 240 \text{ дм}^3$
$3 \cdot V(H_2) = 240 \text{ дм}^3$
$V(H_2) = \frac{240}{3} = 80 \text{ дм}^3$
Соответственно, объем кислорода:
$V(O_2) = 2 \cdot 80 = 160 \text{ дм}^3$
3. Определим лимитирующий реагент. Согласно стехиометрии реакции $2H_{2} + O_{2}$, на 2 моль (или 2 объемные части) водорода требуется 1 моль (или 1 объемная часть) кислорода.
Для полного сгорания $80 \text{ дм}^3$ водорода необходимо кислорода в объеме:
$V(O_2)_{\text{теор.}} = \frac{V(H_2)}{2} = \frac{80 \text{ дм}^3}{2} = 40 \text{ дм}^3$
В исходной смеси содержится $160 \text{ дм}^3$ кислорода, что значительно больше необходимого количества ($160 \text{ дм}^3 > 40 \text{ дм}^3$). Это означает, что кислород находится в избытке, а водород является лимитирующим реагентом и вступает в реакцию полностью. Дальнейшие расчеты будем вести по водороду.
4. Найдем количество вещества прореагировавшего водорода. Расчет ведем для нормальных условий (н. у.), где молярный объем газа $V_m = 22.4 \text{ дм}^3/\text{моль}$.
$\nu(H_2) = \frac{V(H_2)}{V_m} = \frac{80 \text{ дм}^3}{22.4 \text{ дм}^3/\text{моль}} \approx 3.5714 \text{ моль}$
5. Рассчитаем тепловой эффект реакции ($Q_{\text{р}}$) в соответствии со стехиометрическими коэффициентами в уравнении, то есть для сгорания 2 моль водорода. По условию, при сгорании $\approx 3.5714 \text{ моль } H_2$ выделилось $1021 \text{ кДж}$ теплоты.
Составим пропорцию:
Сгорание $3.5714 \text{ моль } H_2$ — выделяется $1021 \text{ кДж}$
Сгорание $2 \text{ моль } H_2$ — выделяется $Q_{\text{р}}$
$Q_{\text{р}} = \frac{2 \text{ моль} \cdot 1021 \text{ кДж}}{3.5714 \text{ моль}} = \frac{2 \cdot 1021 \cdot 22.4}{80} = 571.76 \text{ кДж}$
Полученное значение очень близко к стандартной энтальпии образования двух моль жидкой воды ($2 \cdot 285.8 \text{ кДж/моль} = 571.6 \text{ кДж}$). Это позволяет нам указать в уравнении агрегатное состояние воды как жидкое (ж). Округлим рассчитанное значение до целого числа: $572 \text{ кДж}$.
6. Запишем итоговое термохимическое уравнение. Поскольку теплота выделяется (экзотермическая реакция), мы указываем ее со знаком плюс в правой части уравнения.
$2H_{2(г)} + O_{2(г)} = 2H_2O_{(ж)} + 572 \text{ кДж}$
Ответ: $2H_{2(г)} + O_{2(г)} = 2H_2O_{(ж)} + 572 \text{ кДж}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 517 расположенного на странице 80 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №517 (с. 80), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














