Номер 57, страница 14 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 2. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения - номер 57, страница 14.
№57 (с. 14)
Условие. №57 (с. 14)
скриншот условия

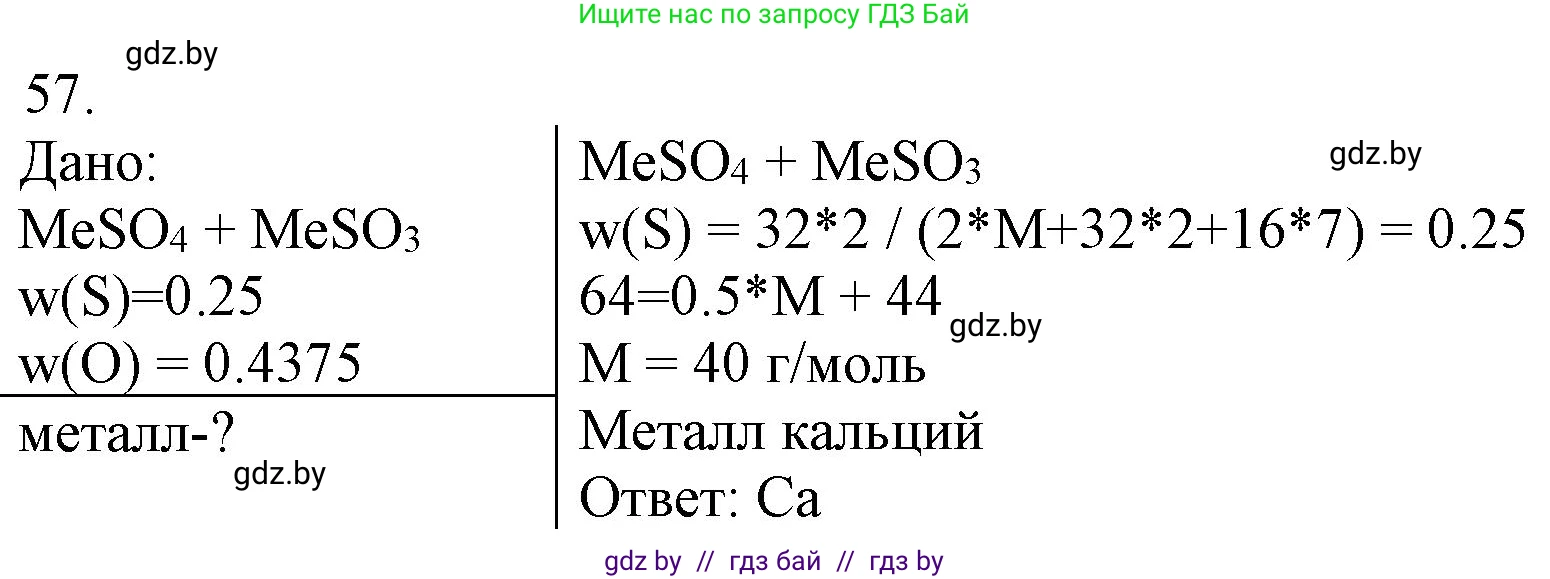
57. *В смеси сульфита и сульфата щёлочноземельного металла массовая доля серы равна 0,2500, а кислорода — 0,4375. Установите металл.
Решение. №57 (с. 14)
Решение 3. №57 (с. 14)
Дано:
Смесь сульфита ($MeSO_3$) и сульфата ($MeSO_4$) щёлочноземельного металла ($Me$).
Массовая доля серы в смеси $\omega(\text{S}) = 0,2500$.
Массовая доля кислорода в смеси $\omega(\text{O}) = 0,4375$.
Найти:
Установить щёлочноземельный металл $Me$.
Решение:
1. Обозначим щёлочноземельный металл как $Me$. Его соли будут иметь формулы $MeSO_3$ (сульфит) и $MeSO_4$ (сульфат), так как щёлочноземельные металлы проявляют степень окисления +2, а сульфит- и сульфат-ионы имеют заряд -2.
2. Найдем соотношение количеств вещества (мольное соотношение) атомов кислорода и серы в смеси. Для этого воспользуемся их массовыми долями и молярными массами ($M(\text{S}) \approx 32$ г/моль, $M(\text{O}) \approx 16$ г/моль).
Пусть масса смеси равна $m_{смеси}$. Тогда масса серы $m(\text{S}) = 0,2500 \cdot m_{смеси}$ и масса кислорода $m(\text{O}) = 0,4375 \cdot m_{смеси}$.
Количество вещества атомов серы: $n(\text{S}) = \frac{m(\text{S})}{M(\text{S})} = \frac{0,2500 \cdot m_{смеси}}{32}$.
Количество вещества атомов кислорода: $n(\text{O}) = \frac{m(\text{O})}{M(\text{O})} = \frac{0,4375 \cdot m_{смеси}}{16}$.
Найдем их мольное соотношение:
$\frac{n(\text{O})}{n(\text{S})} = \frac{0,4375 \cdot m_{смеси} / 16}{0,2500 \cdot m_{смеси} / 32} = \frac{0,4375}{16} \cdot \frac{32}{0,2500} = \frac{0,4375 \cdot 2}{0,2500} = \frac{0,875}{0,250} = 3,5$
3. Выразим это соотношение через мольные количества солей в смеси. Пусть в смеси содержится $x$ моль $MeSO_3$ и $y$ моль $MeSO_4$.
Тогда общее количество вещества атомов серы: $n(\text{S}) = x + y$.
Общее количество вещества атомов кислорода: $n(\text{O}) = 3x + 4y$.
Составим уравнение на основе найденного соотношения:
$\frac{n(\text{O})}{n(\text{S})} = \frac{3x + 4y}{x + y} = 3,5$
$3x + 4y = 3,5(x + y)$
$3x + 4y = 3,5x + 3,5y$
$4y - 3,5y = 3,5x - 3x$
$0,5y = 0,5x$
$x = y$
Это означает, что смесь является эквимолярной, то есть содержит одинаковое количество молей сульфита и сульфата металла.
4. Зная, что смесь эквимолярная, можно определить молярную массу неизвестного металла $M_{Me}$. Рассчитаем массовую долю серы для смеси, состоящей из 1 моль $MeSO_3$ и 1 моль $MeSO_4$.
Молярная масса $MeSO_3$: $M(MeSO_3) = M_{Me} + M(\text{S}) + 3 \cdot M(\text{O}) = M_{Me} + 32 + 3 \cdot 16 = M_{Me} + 80$ (г/моль).
Молярная масса $MeSO_4$: $M(MeSO_4) = M_{Me} + M(\text{S}) + 4 \cdot M(\text{O}) = M_{Me} + 32 + 4 \cdot 16 = M_{Me} + 96$ (г/моль).
Масса смеси из 1 моль каждой соли: $m_{смеси} = (M_{Me} + 80) + (M_{Me} + 96) = 2M_{Me} + 176$ г.
Масса серы в этой смеси: $m(\text{S}) = M(\text{S}) + M(\text{S}) = 32 + 32 = 64$ г.
Массовая доля серы в такой смеси равна:
$\omega(\text{S}) = \frac{m(\text{S})}{m_{смеси}} = \frac{64}{2M_{Me} + 176}$
По условию задачи $\omega(\text{S}) = 0,2500 = \frac{1}{4}$. Приравняем выражения:
$\frac{64}{2M_{Me} + 176} = \frac{1}{4}$
$64 \cdot 4 = 1 \cdot (2M_{Me} + 176)$
$256 = 2M_{Me} + 176$
$2M_{Me} = 256 - 176$
$2M_{Me} = 80$
$M_{Me} = 40$ г/моль.
5. Щёлочноземельный металл с молярной массой 40 г/моль — это кальций (Ca).
Ответ: искомый металл – кальций (Ca).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 57 расположенного на странице 14 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №57 (с. 14), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














