Номер 87, страница 20 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 3. Основные классы неорганических соединений - номер 87, страница 20.
№87 (с. 20)
Условие. №87 (с. 20)
скриншот условия

87. Амигдалин ($C_{20}H_{27}NO_{11}$) содержится в косточках горького миндаля, персика, абрикоса, вишни, яблони и некоторых других растений. При разложении в организме одной молекулы амигдалина образуется одна молекула цианистого водорода $HCN$, который является сильнейшим ядом. Приём внутрь примерно 50–60 г ядрышек растений, содержащих амигдалин, может привести к тяжёлому и даже смертельному отравлению человека. Содержание амигдалина в горьком миндале может доходить до 3,5 % по массе. Цианистый водород какой максимальной массы может образоваться в результате разложения амигдалина, содержащегося в горьком миндале массой 60 г?
Решение. №87 (с. 20)
Решение 3. №87 (с. 20)
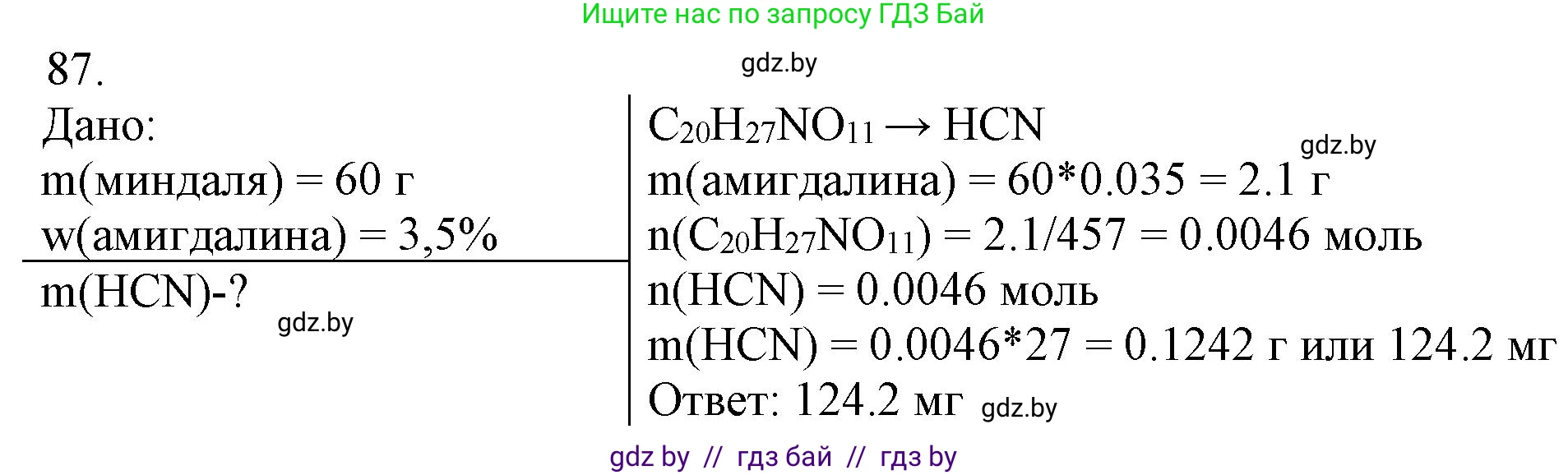
Дано:
Масса горького миндаля $m_{миндаля} = 60$ г
Максимальная массовая доля амигдалина $w(C_{20}H_{27}NO_{11}) = 3,5 \%$
$m_{миндаля} = 0,06$ кг
$w(C_{20}H_{27}NO_{11}) = 0,035$
Найти:
$m(HCN)_{max} - ?$
Решение:
1. Найдем максимальную массу амигдалина $(C_{20}H_{27}NO_{11})$, которая содержится в 60 г горького миндаля. Для этого массу миндаля умножим на массовую долю амигдалина, выраженную в долях единицы.
$m(C_{20}H_{27}NO_{11}) = m_{миндаля} \times w(C_{20}H_{27}NO_{11}) = 60 \text{ г} \times 0,035 = 2,1 \text{ г}$
2. Рассчитаем молярные массы амигдалина $(C_{20}H_{27}NO_{11})$ и цианистого водорода $(HCN)$, используя относительные атомные массы химических элементов (округленные до целых): $Ar(C)=12$, $Ar(H)=1$, $Ar(N)=14$, $Ar(O)=16$.
$M(C_{20}H_{27}NO_{11}) = 20 \times Ar(C) + 27 \times Ar(H) + 1 \times Ar(N) + 11 \times Ar(O) = 20 \times 12 + 27 \times 1 + 14 + 11 \times 16 = 240 + 27 + 14 + 176 = 457 \text{ г/моль}$
$M(HCN) = Ar(H) + Ar(C) + Ar(N) = 1 + 12 + 14 = 27 \text{ г/моль}$
3. Из условия задачи известно, что при разложении одной молекулы амигдалина образуется одна молекула цианистого водорода. Это означает, что их количества вещества (число молей) соотносятся как 1:1.
Упрощенная схема реакции: $C_{20}H_{27}NO_{11} \rightarrow HCN + ...$
Из стехиометрии реакции следует: $n(C_{20}H_{27}NO_{11}) = n(HCN)$.
4. Найдем количество вещества амигдалина в 2,1 г.
$n(C_{20}H_{27}NO_{11}) = \frac{m(C_{20}H_{27}NO_{11})}{M(C_{20}H_{27}NO_{11})} = \frac{2,1 \text{ г}}{457 \text{ г/моль}} \approx 0,004595 \text{ моль}$
5. Поскольку количество вещества цианистого водорода равно количеству вещества амигдалина, можем рассчитать массу $HCN$.
$n(HCN) \approx 0,004595 \text{ моль}$
$m(HCN) = n(HCN) \times M(HCN) \approx 0,004595 \text{ моль} \times 27 \text{ г/моль} \approx 0,124065 \text{ г}$
Округлим полученный результат до двух значащих цифр, так как исходные данные (60 г и 3,5 %) имеют две значащие цифры.
$m(HCN) \approx 0,12 \text{ г}$
Ответ: максимальная масса цианистого водорода, которая может образоваться, составляет 0,12 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 87 расположенного на странице 20 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №87 (с. 20), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














