Номер 92, страница 21 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 3. Основные классы неорганических соединений - номер 92, страница 21.
№92 (с. 21)
Условие. №92 (с. 21)
скриншот условия

92. *Желудочный сок вырабатывается клетками слизистой оболочки желудка и имеет сложный химический состав. Его основное назначение — переваривание пищи. В состав желудочного сока входит соляная кислота. Она поддерживает определённый уровень кислотности в желудке и способствует денатурации белков, что облегчает их последующее расщепление, активирует пищеварительные ферменты, обеспечивает антибактериальное действие желудочного сока. В $1\text{ дм}^3$ желудочного сока в среднем содержится $0,160\text{ моль HCl}$. В течение суток в желудке взрослого человека вырабатывается около $2\text{ литров}$ желудочного сока. Рассчитайте массовую долю хлороводорода в желудочном соке, приняв плотность желудочного сока равной $1,005\text{ г}/\text{см}^3$. Какая масса соляной кислоты вырабатывается в желудке взрослого человека в течение одного года?Для растворения железа какой массы достаточно такого количества кислоты?
Решение. №92 (с. 21)
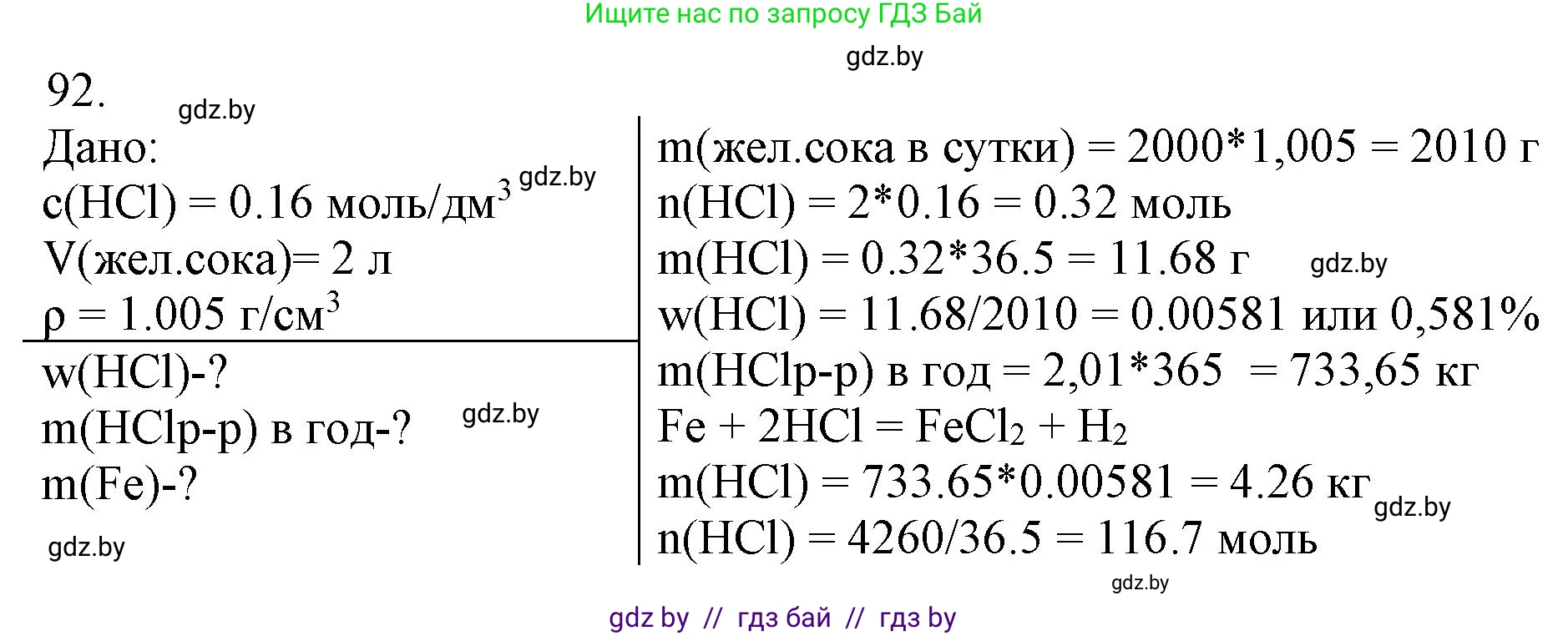

Решение 3. №92 (с. 21)
Дано:
Концентрация $HCl$ в желудочном соке: $C(HCl) = 0,160 \text{ моль/дм}^3$
Суточный объем желудочного сока: $V_{сутки} = 2 \text{ л}$
Плотность желудочного сока: $\rho_{сока} = 1,005 \text{ г/см}^3$
Продолжительность: $t = 1 \text{ год} = 365 \text{ суток}$
Для удобства расчетов переведем единицы:
$1 \text{ дм}^3 = 1 \text{ л} = 1000 \text{ см}^3$
$\rho_{сока} = 1,005 \text{ г/см}^3 = 1005 \text{ г/дм}^3 = 1005 \text{ г/л}$
Найти:
1. Массовую долю хлороводорода: $\omega(HCl) - ?$
2. Массу соляной кислоты, выработанной за год: $m_{год}(HCl) - ?$
3. Массу железа, которую можно растворить: $m(Fe) - ?$
Решение:
Рассчитайте массовую долю хлороводорода в желудочном соке, приняв плотность желудочного сока равной 1,005 г/см³.
1. Для расчета массовой доли возьмем объем желудочного сока, равный 1 дм³ (1 л), и найдем его массу.
$V_{сока} = 1 \text{ дм}^3 = 1000 \text{ см}^3$
Масса раствора (сока): $m_{сока} = V_{сока} \cdot \rho_{сока} = 1000 \text{ см}^3 \cdot 1,005 \text{ г/см}^3 = 1005 \text{ г}$.
2. Найдем массу хлороводорода ($HCl$) в 1 дм³ желудочного сока.
Молярная масса $HCl$: $M(HCl) = M(H) + M(Cl) \approx 1 + 35,5 = 36,5 \text{ г/моль}$.
Согласно условию, в 1 дм³ сока содержится $n(HCl) = 0,160 \text{ моль}$.
Масса $HCl$: $m(HCl) = n(HCl) \cdot M(HCl) = 0,160 \text{ моль} \cdot 36,5 \text{ г/моль} = 5,84 \text{ г}$.
3. Рассчитаем массовую долю $HCl$ по формуле $\omega = \frac{m_{вещества}}{m_{раствора}}$.
$\omega(HCl) = \frac{m(HCl)}{m_{сока}} = \frac{5,84 \text{ г}}{1005 \text{ г}} \approx 0,00581$.
В процентах: $0,00581 \cdot 100\% = 0,581\%$.
Ответ: Массовая доля хлороводорода в желудочном соке составляет приблизительно 0,581%.
Какая масса соляной кислоты вырабатывается в желудке взрослого человека в течение одного года?
1. Найдем количество вещества $HCl$, вырабатываемое за сутки.
$V_{сутки} = 2 \text{ л} = 2 \text{ дм}^3$
$n_{сутки}(HCl) = C(HCl) \cdot V_{сутки} = 0,160 \text{ моль/дм}^3 \cdot 2 \text{ дм}^3 = 0,32 \text{ моль}$.
2. Найдем количество вещества $HCl$, вырабатываемое за год (примем 365 суток).
$n_{год}(HCl) = n_{сутки}(HCl) \cdot 365 = 0,32 \text{ моль} \cdot 365 = 116,8 \text{ моль}$.
3. Найдем массу $HCl$, вырабатываемую за год.
$m_{год}(HCl) = n_{год}(HCl) \cdot M(HCl) = 116,8 \text{ моль} \cdot 36,5 \text{ г/моль} = 4263,2 \text{ г} \approx 4,26 \text{ кг}$.
Ответ: В течение одного года в желудке взрослого человека вырабатывается 4263,2 г (или ≈4,26 кг) соляной кислоты.
Для растворения железа какой массы достаточно такого количества кислоты?
1. Запишем уравнение реакции взаимодействия железа с соляной кислотой:
$Fe + 2HCl \rightarrow FeCl_2 + H_2 \uparrow$
2. Из уравнения реакции следует, что на 1 моль железа ($Fe$) расходуется 2 моль соляной кислоты ($HCl$). Соотношение количеств веществ:
$\frac{n(Fe)}{1} = \frac{n(HCl)}{2} \Rightarrow n(Fe) = \frac{1}{2} n(HCl)$
3. Используем количество вещества кислоты, выработанной за год: $n_{год}(HCl) = 116,8 \text{ моль}$.
Найдем соответствующее количество вещества железа:
$n(Fe) = \frac{1}{2} \cdot 116,8 \text{ моль} = 58,4 \text{ моль}$.
4. Найдем массу железа, которая может прореагировать с этим количеством кислоты.
Молярная масса железа: $M(Fe) \approx 56 \text{ г/моль}$.
$m(Fe) = n(Fe) \cdot M(Fe) = 58,4 \text{ моль} \cdot 56 \text{ г/моль} = 3270,4 \text{ г} \approx 3,27 \text{ кг}$.
Ответ: Годового количества соляной кислоты достаточно для растворения 3270,4 г (или ≈3,27 кг) железа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 92 расположенного на странице 21 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №92 (с. 21), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














