Номер 879, страница 159 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Готовимся к олимпиадам - номер 879, страница 159.
№879 (с. 159)
Условие. №879 (с. 159)
скриншот условия

879. Дополните уравнения химических реакций, для которых ниже приведены их правые части с учётом стехиометрических коэффициентов:
... $\to$ $2\text{HNO}_3$ + $\text{NO}\uparrow$;
... $\to$ $\text{N}_2\text{O}$ + $2\text{H}_2\text{O}$;
... $\to$ $\text{HNO}_3$ + $\text{HNO}_2$;
... $\to$ $\text{MnO}_2$ + $2\text{NO}_2\uparrow$;
... $\to$ $\text{NH}_4\text{NO}_3$;
... $\to$ $4\text{NO}_2$ + $\text{O}_2$.
... $\to$ $\text{N}_2$ + $2\text{H}_2\text{O}$ + $\text{NaCl}$;
Укажите условия осуществления каждой из реакций.
Решение. №879 (с. 159)
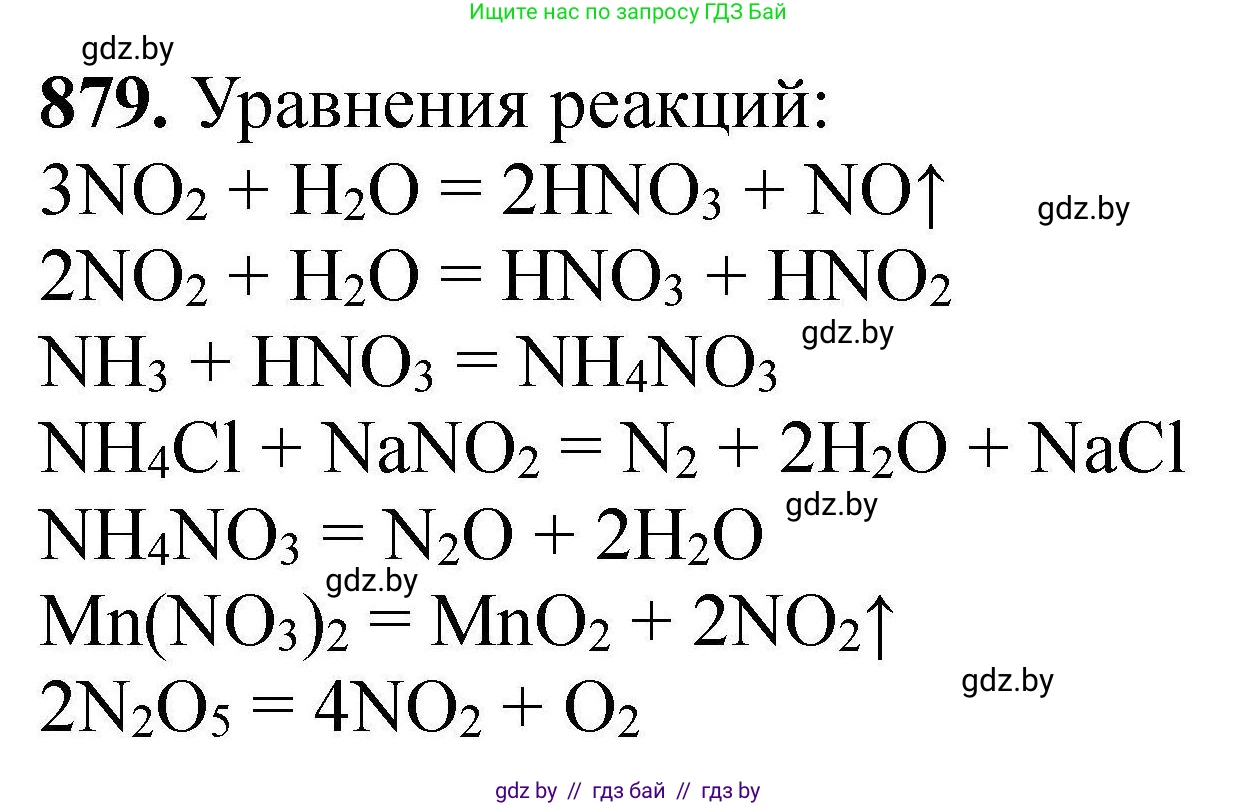
Решение 2. №879 (с. 159)
... → 2HNO₃ + NO↑
В правой части уравнения находятся продукты с разными степенями окисления азота: +5 в азотной кислоте ($HNO_3$) и +2 в оксиде азота(II) ($NO$). Это указывает на реакцию диспропорционирования, где исходное вещество содержит азот в промежуточной степени окисления +4. Таким веществом является оксид азота(IV) ($NO_2$), который реагирует с водой. Для балансировки атомов необходимо взять 3 молекулы $NO_2$ и 1 молекулу $H_2O$.
Реакция протекает при растворении диоксида азота в воде, обычно при охлаждении. Это одна из стадий промышленного синтеза азотной кислоты.
Ответ: Уравнение реакции: $3NO_2 + H_2O \rightarrow 2HNO_3 + NO\uparrow$. Условия: взаимодействие с водой, охлаждение.
... → HNO₃ + HNO₂
В продуктах реакции присутствуют азотная ($HNO_3$) и азотистая ($HNO_2$) кислоты, где азот имеет степени окисления +5 и +3 соответственно. Это также реакция диспропорционирования, исходным веществом в которой является соединение азота со степенью окисления +4. Это может быть оксид азота(IV) ($NO_2$) или его димер, тетраоксид диазота ($N_2O_4$). Реакция с водой приводит к образованию двух кислот.
Реакция происходит при взаимодействии $NO_2$ (или $N_2O_4$) с холодной водой. При нагревании азотистая кислота разлагается.
Ответ: Уравнение реакции: $2NO_2 + H_2O \rightarrow HNO_3 + HNO_2$ (или $N_2O_4 + H_2O \rightarrow HNO_3 + HNO_2$). Условия: взаимодействие с холодной водой.
... → NH₄NO₃
Продукт реакции — нитрат аммония ($NH_4NO_3$), соль, образованная слабым основанием и сильной кислотой. Такой продукт получается в результате реакции нейтрализации между аммиаком ($NH_3$) и азотной кислотой ($HNO_3$).
Реакция является типичной кислотно-основной реакцией и протекает самопроизвольно при смешивании реагентов, часто с выделением тепла.
Ответ: Уравнение реакции: $NH_3 + HNO_3 \rightarrow NH_4NO_3$. Условия: обычные условия (реакция протекает при комнатной температуре).
... → N₂ + 2H₂O + NaCl
Образование молекулярного азота ($N_2$, степень окисления 0) указывает на окислительно-восстановительную реакцию. Часто азот получают реакцией сопропорционирования, где азот из степени окисления -3 (в ионе аммония $NH_4^+$) и +3 (в нитрит-ионе $NO_2^-$) переходит в степень окисления 0. Наличие в продуктах ионов $Na^+$ и $Cl^-$ указывает на то, что исходными реагентами были хлорид аммония ($NH_4Cl$) и нитрит натрия ($NaNO_2$).
Реакция проводится при осторожном нагревании водного раствора смеси реагентов.
Ответ: Уравнение реакции: $NH_4Cl + NaNO_2 \rightarrow N_2\uparrow + 2H_2O + NaCl$. Условия: нагревание ($t^\circ$) водного раствора.
... → N₂O + 2H₂O
Продуктами являются оксид азота(I) ($N_2O$) и вода. Подсчет атомов в продуктах (2 атома N, 4 атома H, 3 атома O) показывает, что единственным исходным веществом может быть только нитрат аммония ($NH_4NO_3$).
Это реакция термического разложения нитрата аммония, которая является лабораторным способом получения "веселящего газа" ($N_2O$).
Ответ: Уравнение реакции: $NH_4NO_3 \xrightarrow{t^\circ} N_2O\uparrow + 2H_2O$. Условия: контролируемое нагревание в диапазоне 170–250 °C.
... → MnO₂ + 2NO₂↑
В продуктах присутствуют диоксид марганца ($MnO_2$) и диоксид азота ($NO_2$). Это указывает на термическое разложение нитрата металла. Исходным веществом является нитрат марганца(II) ($Mn(NO_3)_2$). В ходе реакции происходит внутримолекулярное окисление-восстановление: марганец окисляется от +2 до +4, а азот восстанавливается от +5 до +4.
Реакция требует нагревания.
Ответ: Уравнение реакции: $Mn(NO_3)_2 \xrightarrow{t^\circ} MnO_2 + 2NO_2\uparrow$. Условия: нагревание ($t^\circ$).
... → 4NO₂ + O₂
Продуктами являются оксид азота(IV) ($NO_2$) и кислород ($O_2$). Это реакция разложения высшего оксида азота — оксида азота(V), или пентаоксида диазота ($N_2O_5$).
$N_2O_5$ является неустойчивым соединением и разлагается самопроизвольно. Процесс ускоряется при нагревании или под действием света.
Ответ: Уравнение реакции: $2N_2O_5 \rightarrow 4NO_2\uparrow + O_2\uparrow$. Условия: комнатная температура, процесс ускоряется при нагревании ($t^\circ$) или на свету ($h\nu$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 879 расположенного на странице 159 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №879 (с. 159), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














