Номер 145, страница 30 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 1. Основные понятия и законы химии. Параграф 5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ - номер 145, страница 30.
№145 (с. 30)
Условие. №145 (с. 30)
скриншот условия

145. При взаимодействии углерода массой 1,20 г с серой массой 6,40 г образовалось новое вещество. Чему равна плотность паров этого вещества при н. у.?
Решение. №145 (с. 30)
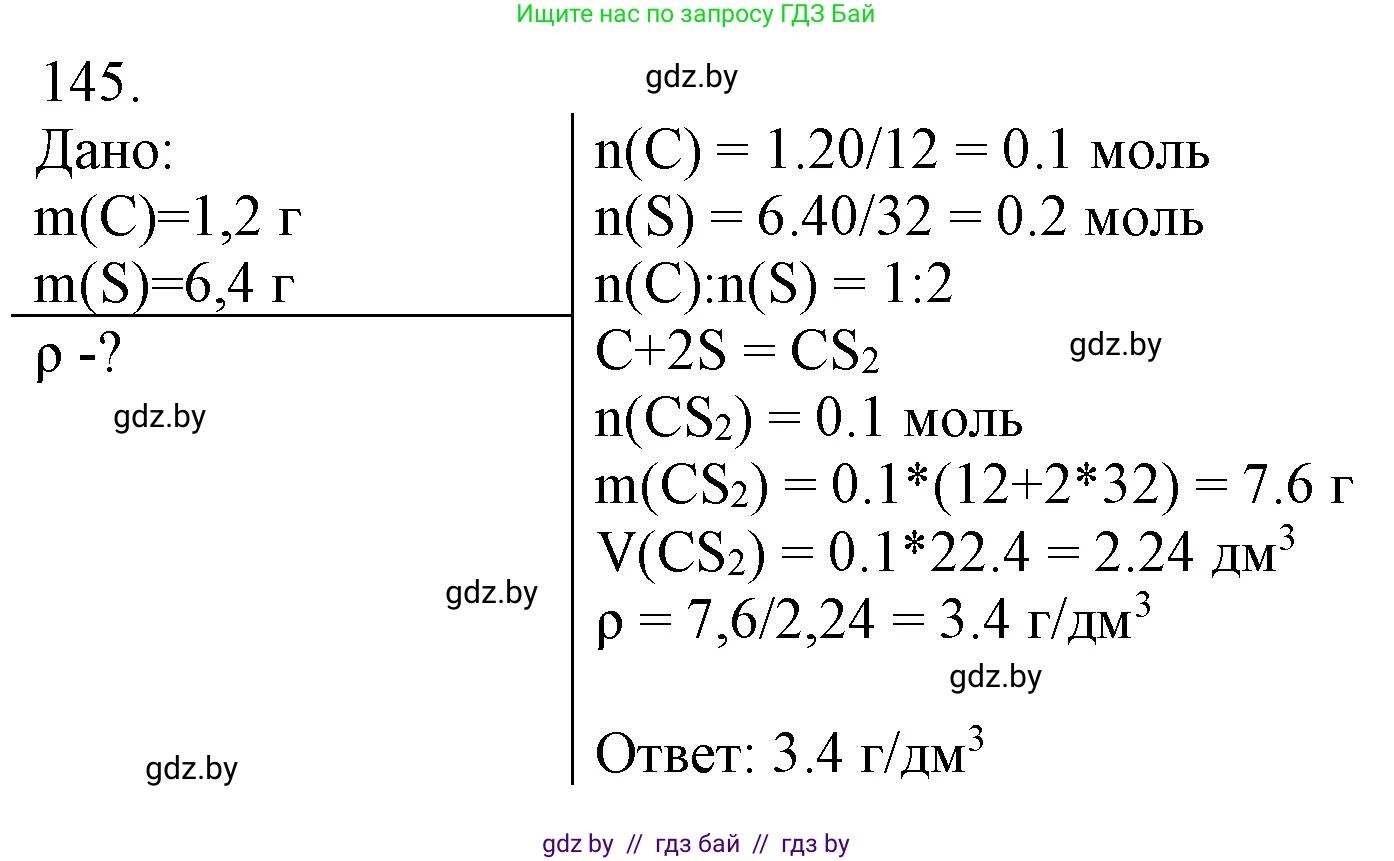
Решение 3. №145 (с. 30)
Дано:
Масса углерода, $m(C) = 1,20 \text{ г}$
Масса серы, $m(S) = 6,40 \text{ г}$
$m(C) = 1,20 \cdot 10^{-3} \text{ кг}$
$m(S) = 6,40 \cdot 10^{-3} \text{ кг}$
Найти:
Плотность паров вещества при н. у. - $\rho(\text{вещества})$
Решение:
1. Для определения формулы образовавшегося вещества найдем количество вещества (моль) для каждого реагента. Для расчетов будем использовать массы в граммах и молярные массы из Периодической таблицы Д. И. Менделеева, округленные до целых чисел:
$M(C) = 12 \text{ г/моль}$
$M(S) = 32 \text{ г/моль}$
Рассчитаем количество вещества для углерода и серы:
$\nu(C) = \frac{m(C)}{M(C)} = \frac{1,20 \text{ г}}{12 \text{ г/моль}} = 0,10 \text{ моль}$
$\nu(S) = \frac{m(S)}{M(S)} = \frac{6,40 \text{ г}}{32 \text{ г/моль}} = 0,20 \text{ моль}$
2. Найдем мольное соотношение атомов углерода и серы в продукте реакции:
$\nu(C) : \nu(S) = 0,10 : 0,20$
Чтобы найти простейшее целочисленное соотношение, разделим оба значения на наименьшее из них (0,10):
$C : S = \frac{0,10}{0,10} : \frac{0,20}{0,10} = 1 : 2$
Таким образом, простейшая формула полученного вещества — $CS_2$ (сероуглерод). Запишем уравнение реакции, чтобы убедиться, что реагенты находятся в стехиометрическом соотношении:
$C + 2S \rightarrow CS_2$
Согласно уравнению, 1 моль углерода реагирует с 2 молями серы. Так как у нас в наличии 0,10 моль углерода и 0,20 моль серы, реагенты вступают в реакцию полностью, без остатка.
3. Рассчитаем молярную массу сероуглерода ($CS_2$):
$M(CS_2) = M(C) + 2 \cdot M(S) = 12 \text{ г/моль} + 2 \cdot 32 \text{ г/моль} = 76 \text{ г/моль}$
4. Плотность ($\rho$) паров вещества при нормальных условиях (н. у.) вычисляется как отношение молярной массы ($M$) к молярному объему газов ($V_m$), который при н. у. составляет $22,4 \text{ л/моль}$.
$\rho = \frac{M}{V_m}$
Подставив значения для паров сероуглерода, получим:
$\rho(CS_2) = \frac{76 \text{ г/моль}}{22,4 \text{ л/моль}} \approx 3,3928 \text{ г/л}$
Учитывая, что массы исходных веществ даны с тремя значащими цифрами, округлим результат до трех значащих цифр:
$\rho(CS_2) \approx 3,39 \text{ г/л}$
Ответ: плотность паров этого вещества при н. у. равна $3,39 \text{ г/л}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 145 расположенного на странице 30 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №145 (с. 30), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














