Номер 443, страница 67 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 16. Типы кристаллических структур - номер 443, страница 67.
№443 (с. 67)
Условие. №443 (с. 67)
скриншот условия

443. *Относительная плотность по воздуху соединения, молекула которого состоит из атомов водорода и азота, такая же, как и у кислорода. Массовая доля водорода составляет в нём 12,58 %. Установите химическую формулу этого соединения.
Решение. №443 (с. 67)
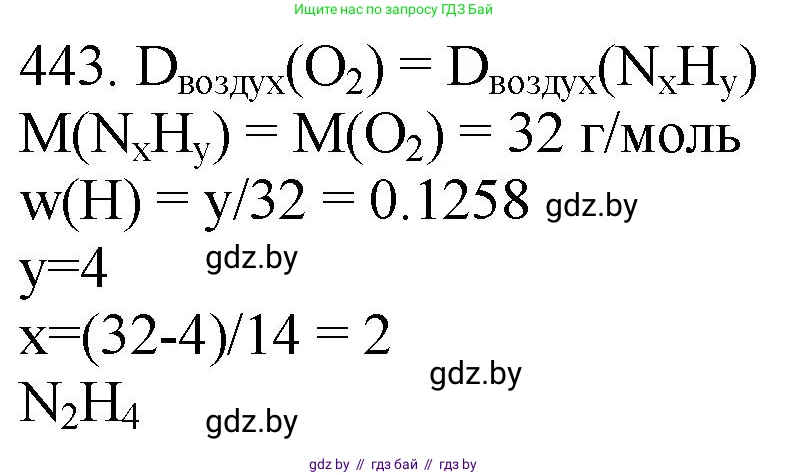
Решение 3. №443 (с. 67)
Дано:
Соединение состоит из азота (N) и водорода (H), обозначим его формулу как $N_xH_y$.
Относительная плотность по воздуху соединения равна относительной плотности по воздуху кислорода: $D_{воздух}(N_xH_y) = D_{воздух}(O_2)$.
Массовая доля водорода в соединении: $\omega(H) = 12.58\% = 0.1258$.
Найти:
Химическую формулу соединения $N_xH_y$.
Решение:
1.Найдем молярную массу неизвестного соединения.
Относительная плотность газа 1 по газу 2 ($D_{газ2}(газ1)$) — это отношение их молярных масс:
$D_{газ2}(газ1) = \frac{M(газ1)}{M(газ2)}$
Из условия задачи известно, что относительные плотности по воздуху для искомого соединения и для кислорода равны:
$D_{воздух}(N_xH_y) = D_{воздух}(O_2)$
Следовательно, равны и их молярные массы:
$\frac{M(N_xH_y)}{M_{воздух}} = \frac{M(O_2)}{M_{воздух}} \implies M(N_xH_y) = M(O_2)$
Вычислим молярную массу кислорода $O_2$, используя относительные атомные массы: $Ar(O) \approx 16$.
$M(O_2) = 2 \times Ar(O) = 2 \times 16 = 32$ г/моль.
Таким образом, молярная масса искомого соединения $M(N_xH_y)$ также равна 32 г/моль.
2.Установим простейшую (эмпирическую) формулу соединения.
Соединение состоит из азота и водорода. Найдем массовую долю азота:
$\omega(N) = 100\% - \omega(H) = 100\% - 12.58\% = 87.42\%$.
Соотношение индексов в формуле $N_xH_y$ пропорционально соотношению количеств вещества (молей) атомов в соединении. Для нахождения этого соотношения разделим массовые доли элементов на их относительные атомные массы ($Ar(N) \approx 14, Ar(H) \approx 1$):
$x : y = \frac{\omega(N)}{Ar(N)} : \frac{\omega(H)}{Ar(H)}$
$x : y = \frac{87.42}{14} : \frac{12.58}{1} = 6.244 : 12.58$
Чтобы найти соотношение в целых числах, разделим оба значения на меньшее из них (6.244):
$x : y = \frac{6.244}{6.244} : \frac{12.58}{6.244} \approx 1 : 2.015$
Округляя до ближайших целых чисел, получаем соотношение $1:2$. Следовательно, простейшая формула соединения — $NH_2$.
3.Определим истинную (молекулярную) формулу соединения.
Истинная формула будет иметь вид $(NH_2)_n$, где n — целое число. Молярная масса истинной формулы должна быть равна найденной ранее (32 г/моль).
$M((NH_2)_n) = 32$ г/моль.
Вычислим молярную массу эмпирической формулы $NH_2$:
$M(NH_2) = Ar(N) + 2 \times Ar(H) = 14 + 2 \times 1 = 16$ г/моль.
Теперь найдем n:
$n \times M(NH_2) = M(N_xH_y)$
$n \times 16 = 32$
$n = \frac{32}{16} = 2$
Следовательно, истинная формула соединения — $(NH_2)_2$, то есть $N_2H_4$ (гидразин).
Проверка: Молярная масса $N_2H_4$ равна $2 \times 14 + 4 \times 1 = 32$ г/моль. Массовая доля водорода $\omega(H) = \frac{4 \times 1}{32} \times 100\% = 12.5\%$. Это значение близко к заданному в условии (12.58%), расхождение объясняется использованием округленных значений атомных масс.
Ответ: $N_2H_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 443 расположенного на странице 67 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №443 (с. 67), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














