Вариант 2, страница 14, часть 1 - гдз по химии 7 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 1
Цвет обложки: розовый с колбами
ISBN: 978-985-597-590-9
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 7 классе
Часть 1. Практические работы. Химический эксперимент. Практическая работа 3. Изучение признаков химических реакций и условий их протекания - страница 14.
Вариант 2 (с. 14)
Условие. Вариант 2 (с. 14)
скриншот условия






Вариант ___________
Задание 1, 2, 3(__), 4(__)
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
I. Изменение цвета
В пробирку налейте приблизительно 1 $см^3$ крахмального клейстера ($C_6H_{10}O_5$)$_n$ и добавьте такой же объем иодной воды $I_2$. Опишите наблюдаемые явления.
1)
2)
$I_2$
Крахмальный клейстер ($C_6H_{10}O_5$)$_n$
II. Образование осадка
В пробирку налейте приблизительно 1 $см^3$ раствора сульфата меди(II) $CuSO_4$ и добавьте немного меньший объем раствора щелочи гидроксид натрия $NaOH$. Опишите наблюдаемые явления.
1)
$NaOH$
2)
$CuSO_4$
Условия проведения опыта (соприкосновение веществ, нагревание)
Наблюдения
Выводы
Признаком химической реакции между крахмальным клейстером ($C_6H_{10}O_5$)$_n$ и иодной водой $I_2$ является
Реакция протекает при соприкосновении веществ без нагревания.
Признаком химической реакции между растворами
Реакция протекает при
Реактивы: свежеприготовленный крахмальный клейстер($C_6H_{10}O_5$), иодная вода $I_2$, раствор сульфата меди(II) $CuSO_4$, раствор щелочи гидроксид натрия $NaOH$, питьевая сода $NaHCO_3$, раствор одной из кислот: хлороводородной $HCl$, серной $H_2SO_4$, уксусной $CH_3COOH$; лимонной $C_6H_8O_7$.
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
III. Растворение осадка
К полученному в предыдущем опыте осадку (его название и формула: гидроксид меди(II) $Cu(OH)_2$) добавьте раствор кислоты:
а) хлороводородной;
б) серной;
в) уксусной;
г) лимонной.
Опишите наблюдаемые явления.
1)
кислота
2)
$Cu(OH)_2$
IV. Выделение газа
В пробирку на донышко насыпьте немного питьевой соды $NaHCO_3$ и осторожно, по каплям, добавьте 1 $см^3$ раствора кислоты:
а) хлороводородной;
б) серной;
в) уксусной;
г) лимонной.
Опишите наблюдаемые явления.
1)
2)
Условия проведения опыта (соприкосновение веществ, нагревание)
Наблюдения
Выводы
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
V. Выделение теплоты и света
Зажгите спичкой свечу. Приблизите ладонь к пламени и сразу удалите. Опишите наблюдаемые явления. Сделайте рисунок.
1) Парафин;
2) кислород
Вывод
*Задание, Расставьте коэффициенты:
а) $Na_2CO_3 + HCl = NaCl + H_2O + CO_2\uparrow$
$Cu + O_2 = CuO$
$Cu(OH)_2 + HCl = CuCl_2 + H_2O$
б) $CuSO_4 + NaOH = Cu(OH)_2\downarrow + Na_2SO_4$
$Mg + O_2 = MgO$
$Fe + HCl = FeCl_2 + H_2\uparrow$
в) $Cu(OH)_2CO_3 = CuO + CO_2\uparrow + H_2O$
$Zn + O_2 = ZnO$
$Fe(OH)_2 + HCl = FeCl_2 + H_2O$
г) $CuSO_4 + KOH = Cu(OH)_2\downarrow + K_2SO_4$
$Al + Cl_2 = AlCl_3$
$Na_2CO_3 + HCl = NaCl + H_2O + CO_2\uparrow$
Решение. Вариант 2 (с. 14)

Решение 2. Вариант 2 (с. 14)
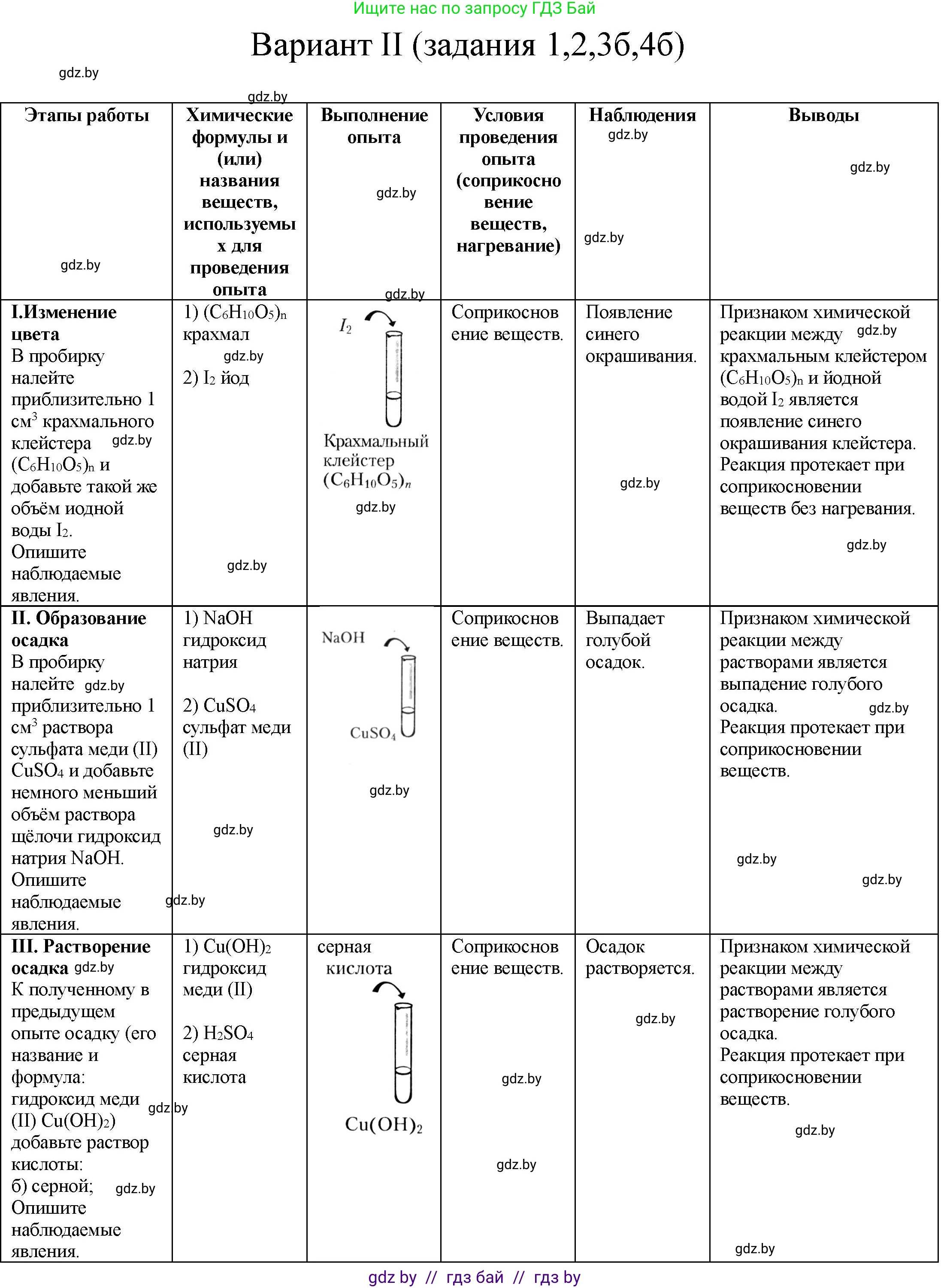
I. Изменение цвета
В пробирку налейте приблизительно 1 см3 крахмального клейстера $(\text{C}_6\text{H}_{10}\text{O}_5)_n$ и добавьте такой же объем йодной воды $\text{I}_2$.
Химические формулы и (или) названия веществ, используемых для проведения опыта:
1) крахмальный клейстер; $(\text{C}_6\text{H}_{10}\text{O}_5)_n$
2) йодная вода; $\text{I}_2$
Опишите наблюдаемые явления: При добавлении йодной воды к крахмальному клейстеру наблюдается появление интенсивного синего (или сине-фиолетового) окрашивания.
Условия проведения опыта (соприкосновение веществ, нагревание): соприкосновение веществ.
Выводы:
Признаком химической реакции между крахмальным клейстером $(\text{C}_6\text{H}_{10}\text{O}_5)_n$ и йодной водой $\text{I}_2$ является: изменение цвета раствора на синий (сине-фиолетовый).
Реакция протекает при соприкосновении веществ без нагревания.
II. Образование осадка
В пробирку налейте приблизительно 1 см3 раствора сульфата меди(II) $\text{CuSO}_4$ и добавьте немного меньший объем раствора щелочи гидроксид натрия $\text{NaOH}$.
Химические формулы и (или) названия веществ, используемых для проведения опыта:
1) сульфат меди(II); $\text{CuSO}_4$
2) гидроксид натрия; $\text{NaOH}$
Опишите наблюдаемые явления: При добавлении раствора гидроксида натрия к раствору сульфата меди(II) образуется голубой студенистый осадок гидроксида меди(II).
Условия проведения опыта (соприкосновение веществ, нагревание): соприкосновение веществ.
Выводы:
Признаком химической реакции между растворами $\text{CuSO}_4$ и $\text{NaOH}$ является: образование нерастворимого голубого осадка гидроксида меди(II).
Реакция протекает при: соприкосновении веществ.
Уравнение реакции: $\text{CuSO}_4 (\text{aq}) + 2\text{NaOH} (\text{aq}) \rightarrow \text{Cu(OH)}_2 (\text{s})\downarrow + \text{Na}_2\text{SO}_4 (\text{aq})$
III. Растворение осадка
К полученному в предыдущем опыте осадку (его название и формула: гидроксид меди(II) $\text{Cu(OH)}_2$) добавьте раствор кислоты: а) хлороводородной; б) серной; в) уксусной; г) лимонной.
Химические формулы и (или) названия веществ, используемых для проведения опыта:
1) гидроксид меди(II); $\text{Cu(OH)}_2$
2) кислоты (хлороводородная $\text{HCl}$, серная $\text{H}_2\text{SO}_4$, уксусная $\text{CH}_3\text{COOH}$, лимонная $\text{C}_6\text{H}_8\text{O}_7$)
Опишите наблюдаемые явления: При добавлении любой из перечисленных кислот к голубому осадку гидроксида меди(II) осадок растворяется, образуя прозрачный раствор соли меди синего цвета.
Условия проведения опыта (соприкосновение веществ, нагревание): соприкосновение веществ.
Выводы:
Признаком химической реакции между $\text{Cu(OH)}_2$ и кислотами является: растворение осадка и образование раствора соли меди.
Реакция протекает при: соприкосновении веществ.
Примеры уравнений реакции:
$ \text{Cu(OH)}_2 (\text{s}) + 2\text{HCl} (\text{aq}) \rightarrow \text{CuCl}_2 (\text{aq}) + 2\text{H}_2\text{O} (\text{l}) $
$ \text{Cu(OH)}_2 (\text{s}) + \text{H}_2\text{SO}_4 (\text{aq}) \rightarrow \text{CuSO}_4 (\text{aq}) + 2\text{H}_2\text{O} (\text{l}) $
$ \text{Cu(OH)}_2 (\text{s}) + 2\text{CH}_3\text{COOH} (\text{aq}) \rightarrow \text{Cu(CH}_3\text{COO})_2 (\text{aq}) + 2\text{H}_2\text{O} (\text{l}) $
IV. Выделение газа
В пробирку на донышко насыпьте немного питьевой соды $\text{NaHCO}_3$ и осторожно, по каплям, добавьте 1 см3 раствора кислоты: а) хлороводородной; б) серной; в) уксусной; г) лимонной.
Химические формулы и (или) названия веществ, используемых для проведения опыта:
1) питьевая сода (гидрокарбонат натрия); $\text{NaHCO}_3$
2) кислоты (хлороводородная $\text{HCl}$, серная $\text{H}_2\text{SO}_4$, уксусная $\text{CH}_3\text{COOH}$, лимонная $\text{C}_6\text{H}_8\text{O}_7$)
Опишите наблюдаемые явления: При добавлении любой из перечисленных кислот к питьевой соде наблюдается бурное выделение бесцветного газа.
Условия проведения опыта (соприкосновение веществ, нагревание): соприкосновение веществ.
Выводы:
Признаком химической реакции между $\text{NaHCO}_3$ и кислотами является: выделение газа (углекислого газа $\text{CO}_2$).
Реакция протекает при: соприкосновении веществ.
Примеры уравнений реакции:
$ \text{NaHCO}_3 (\text{s}) + \text{HCl} (\text{aq}) \rightarrow \text{NaCl} (\text{aq}) + \text{H}_2\text{O} (\text{l}) + \text{CO}_2 (\text{g})\uparrow $
$ 2\text{NaHCO}_3 (\text{s}) + \text{H}_2\text{SO}_4 (\text{aq}) \rightarrow \text{Na}_2\text{SO}_4 (\text{aq}) + 2\text{H}_2\text{O} (\text{l}) + 2\text{CO}_2 (\text{g})\uparrow $
$ \text{NaHCO}_3 (\text{s}) + \text{CH}_3\text{COOH} (\text{aq}) \rightarrow \text{CH}_3\text{COONa} (\text{aq}) + \text{H}_2\text{O} (\text{l}) + \text{CO}_2 (\text{g})\uparrow $
V. Выделение теплоты и света
Зажгите спичкой свечу. Приблизьте ладонь к пламени и сразу удалите.
Химические формулы и (или) названия веществ, используемых для проведения опыта:
1) парафин $(\text{C}_x\text{H}_y)$
2) кислород $\text{O}_2$
Опишите наблюдаемые явления: Зажженная свеча горит, испуская свет и тепло. При поднесении ладони к пламени чувствуется тепло.
Условия проведения опыта (соприкосновение веществ, нагревание): нагревание (инициирование реакции горения).
Выводы:
Признаком химической реакции (горения парафина) является: выделение теплоты и света.
Реакция протекает при: нагревании (инициировании реакции).
*Задание. Расставьте коэффициенты:
Дано
а) $\text{Na}_2\text{CO}_3 + \text{HCl} = \text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow$
$\text{Cu} + \text{O}_2 = \text{CuO}$
$\text{Cu(OH)}_2 + \text{HCl} = \text{CuCl}_2 + \text{H}_2\text{O}$
б) $\text{CuSO}_4 + \text{NaOH} = \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4$
$\text{Mg} + \text{O}_2 = \text{MgO}$
$\text{Fe} + \text{HCl} = \text{FeCl}_2 + \text{H}_2\uparrow$
в) $(\text{CuOH})_2\text{CO}_3 = \text{CuO} + \text{CO}_2\uparrow + \text{H}_2\text{O}$
$\text{Zn} + \text{O}_2 = \text{ZnO}$
$\text{Fe(OH)}_2 + \text{HCl} = \text{FeCl}_2 + \text{H}_2\text{O}$
г) $\text{CuSO}_4 + \text{KOH} = \text{Cu(OH)}_2\downarrow + \text{K}_2\text{SO}_4$
$\text{Al} + \text{Cl}_2 = \text{AlCl}_3$
$\text{Na}_2\text{CO}_3 + \text{HCl} = \text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow$
Найти:
Расставить коэффициенты в химических уравнениях.
Решение
а)
1. $\text{Na}_2\text{CO}_3 + \text{HCl} = \text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow$
Для балансировки атомов натрия (Na) и хлора (Cl) необходимо поставить коэффициент 2 перед $\text{HCl}$ и 2 перед $\text{NaCl}$.
$ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
2. $\text{Cu} + \text{O}_2 = \text{CuO}$
Для балансировки атомов кислорода (O) необходимо поставить коэффициент 2 перед $\text{CuO}$, а затем для меди (Cu) - коэффициент 2 перед $\text{Cu}$.
$ 2\text{Cu} + \text{O}_2 = 2\text{CuO} $
3. $\text{Cu(OH)}_2 + \text{HCl} = \text{CuCl}_2 + \text{H}_2\text{O}$
Для балансировки атомов хлора (Cl) необходимо поставить коэффициент 2 перед $\text{HCl}$. Затем для водорода (H) и кислорода (O) - коэффициент 2 перед $\text{H}_2\text{O}$.
$ \text{Cu(OH)}_2 + 2\text{HCl} = \text{CuCl}_2 + 2\text{H}_2\text{O} $
б)
1. $\text{CuSO}_4 + \text{NaOH} = \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4$
Для балансировки атомов натрия (Na) необходимо поставить коэффициент 2 перед $\text{NaOH}$.
$ \text{CuSO}_4 + 2\text{NaOH} = \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4 $
2. $\text{Mg} + \text{O}_2 = \text{MgO}$
Для балансировки атомов кислорода (O) необходимо поставить коэффициент 2 перед $\text{MgO}$, а затем для магния (Mg) - коэффициент 2 перед $\text{Mg}$.
$ 2\text{Mg} + \text{O}_2 = 2\text{MgO} $
3. $\text{Fe} + \text{HCl} = \text{FeCl}_2 + \text{H}_2\uparrow$
Для балансировки атомов хлора (Cl) и водорода (H) необходимо поставить коэффициент 2 перед $\text{HCl}$.
$ \text{Fe} + 2\text{HCl} = \text{FeCl}_2 + \text{H}_2\uparrow $
в)
1. $(\text{CuOH})_2\text{CO}_3 = \text{CuO} + \text{CO}_2\uparrow + \text{H}_2\text{O}$
Предполагаем, что формула основного карбоната меди - $\text{Cu}_2(\text{OH})_2\text{CO}_3$.
Для балансировки атомов меди (Cu) необходимо поставить коэффициент 2 перед $\text{CuO}$. Остальные элементы уже сбалансированы.
$ \text{Cu}_2(\text{OH})_2\text{CO}_3 = 2\text{CuO} + \text{CO}_2\uparrow + \text{H}_2\text{O} $
2. $\text{Zn} + \text{O}_2 = \text{ZnO}$
Для балансировки атомов кислорода (O) необходимо поставить коэффициент 2 перед $\text{ZnO}$, а затем для цинка (Zn) - коэффициент 2 перед $\text{Zn}$.
$ 2\text{Zn} + \text{O}_2 = 2\text{ZnO} $
3. $\text{Fe(OH)}_2 + \text{HCl} = \text{FeCl}_2 + \text{H}_2\text{O}$
Для балансировки атомов хлора (Cl) необходимо поставить коэффициент 2 перед $\text{HCl}$. Затем для водорода (H) и кислорода (O) - коэффициент 2 перед $\text{H}_2\text{O}$.
$ \text{Fe(OH)}_2 + 2\text{HCl} = \text{FeCl}_2 + 2\text{H}_2\text{O} $
г)
1. $\text{CuSO}_4 + \text{KOH} = \text{Cu(OH)}_2\downarrow + \text{K}_2\text{SO}_4$
Для балансировки атомов калия (K) необходимо поставить коэффициент 2 перед $\text{KOH}$.
$ \text{CuSO}_4 + 2\text{KOH} = \text{Cu(OH)}_2\downarrow + \text{K}_2\text{SO}_4 $
2. $\text{Al} + \text{Cl}_2 = \text{AlCl}_3$
Для балансировки атомов хлора (Cl) необходимо найти наименьшее общее кратное для 2 и 3, это 6. Ставим коэффициент 3 перед $\text{Cl}_2$ и 2 перед $\text{AlCl}_3$. Затем для алюминия (Al) - коэффициент 2 перед $\text{Al}$.
$ 2\text{Al} + 3\text{Cl}_2 = 2\text{AlCl}_3 $
3. $\text{Na}_2\text{CO}_3 + \text{HCl} = \text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow$
Данное уравнение уже было в пункте а).
Для балансировки атомов натрия (Na) и хлора (Cl) необходимо поставить коэффициент 2 перед $\text{HCl}$ и 2 перед $\text{NaCl}$.
$ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
а)
$ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
$ 2\text{Cu} + \text{O}_2 = 2\text{CuO} $
$ \text{Cu(OH)}_2 + 2\text{HCl} = \text{CuCl}_2 + 2\text{H}_2\text{O} $
б)
$ \text{CuSO}_4 + 2\text{NaOH} = \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4 $
$ 2\text{Mg} + \text{O}_2 = 2\text{MgO} $
$ \text{Fe} + 2\text{HCl} = \text{FeCl}_2 + \text{H}_2\uparrow $
в)
$ \text{Cu}_2(\text{OH})_2\text{CO}_3 = 2\text{CuO} + \text{CO}_2\uparrow + \text{H}_2\text{O} $
$ 2\text{Zn} + \text{O}_2 = 2\text{ZnO} $
$ \text{Fe(OH)}_2 + 2\text{HCl} = \text{FeCl}_2 + 2\text{H}_2\text{O} $
г)
$ \text{CuSO}_4 + 2\text{KOH} = \text{Cu(OH)}_2\downarrow + \text{K}_2\text{SO}_4 $
$ 2\text{Al} + 3\text{Cl}_2 = 2\text{AlCl}_3 $
$ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 7 класс, для упражнения Вариант 2 расположенного на странице 14 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 2 (с. 14), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.













