Вариант 1, страница 24, часть 1 - гдз по химии 7 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 1
Цвет обложки: розовый с колбами
ISBN: 978-985-597-590-9
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 7 классе
Часть 1. Практические работы. Химический эксперимент. Практическая работа 5. Получение водорода и изучение его свойств - страница 24.
Вариант 1 (с. 24)
Условие. Вариант 1 (с. 24)
скриншот условия






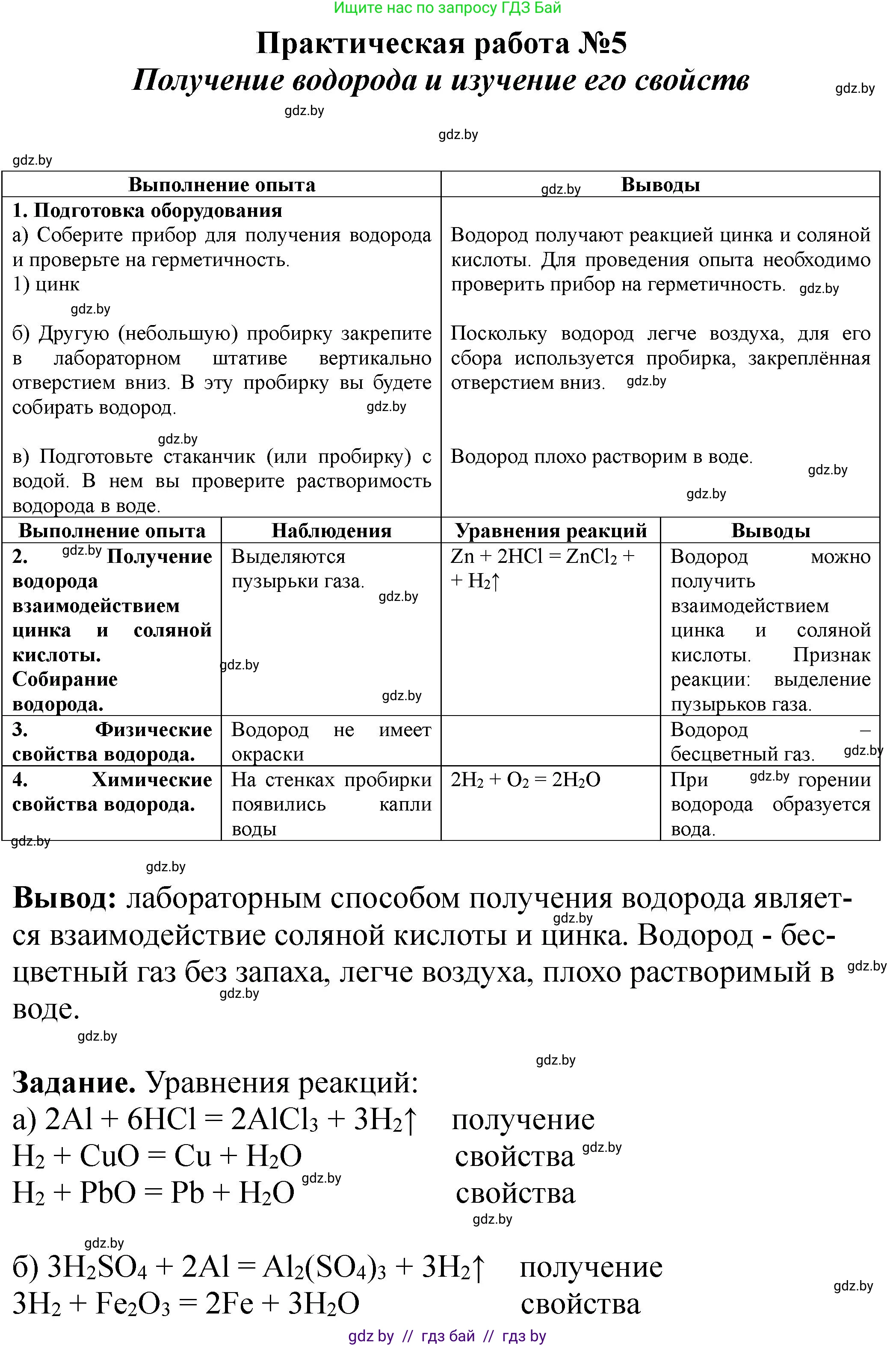
Выполнение опыта
1. Подготовка оборудования
a) Соберите прибор для получения водорода и проверьте на герметичность.Закрепите пробирку в штативе вертикально. Поместите в нее 3–5 гранул цинка. Закройте газоотводной трубкой с пробкой. В этой пробирке вы будете получать водород.
1) _________
б) Другую (небольшую) пробирку закрепите в лабораторном штативе вертикально отверстием вниз. В эту пробирку вы будете собирать водород.
в) Подготовьте стаканчик (или пробирку) с водой. В нем вы проверите растворимость водорода в воде.
Оборудование: 2 штатива, детали прибора для получения газов, стаканчик с водой для проверки прибора на герметичность, маленькая пробирка для собирания водорода, спиртовка, спички.
Выводы
Выполнение опыта Наблюдения
2. Получение водорода взаимодействием цинка и соляной кислоты. Собирание водорода
В пробирку с гранулами цинка прилейте небольшой объем (2–3 $см^3$) раствора хлороводородной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой, конец которой внесите в пробирку, закреплённую в штативе вверх дном, для собирания выделяющегося водорода.
3. Физические свойства водорода
Наблюдайте за протеканием опыта 1–1,5 минуты обратите внимание на отсутствие окраски у водорода.
4. Химические свойства водорода
К отверстию пробирки с собранным водородом поднесите зажженную лучинку или спичку. После реакции водорода с кислородом («хлопок») рассмотрите пробирку, отметьте образование бесцветной жидкости на ее стенках.
Уравнения реакции Выводы
Сделайте вывод о получении водорода в лаборатории и его свойствах.
Вывод
*Задание. Составьте уравнения предложенных реакций. Укажите, какие реакции показывают получение водорода и какие – характеризуют его свойства.
а) $Al + HCl =$
$H_2 + CuO =$
$H_2 + PbO =$
б) $H_2SO_4 + Al =$
$H_2 + Fe_2O_3 =$
$H_2 + Ag_2O =$
в) $HCl + Mg =$
$H_2 + Fe_3O_4 =$
$H_2 + Cu_2O =$
г) $H_2SO_4 + Zn =$
$H_2 + FeO =$
$H_2 + Pb_3O_4 =$
Решение. Вариант 1 (с. 24)
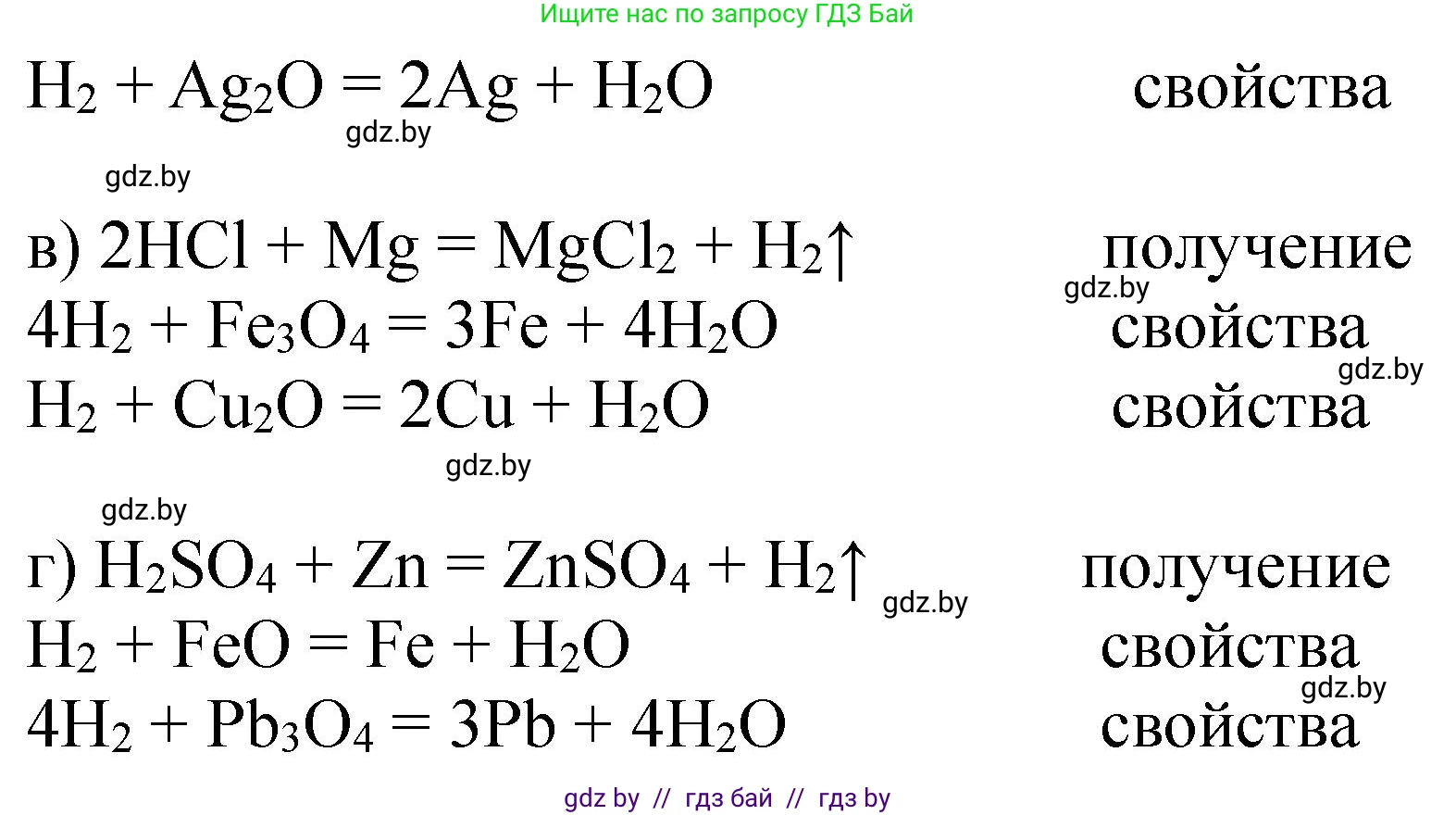
Решение 2. Вариант 1 (с. 24)
a) $2\text{Al} + 6\text{HCl} \to 2\text{AlCl}_3 + 3\text{H}_2\uparrow$. Эта реакция показывает получение водорода.
$\text{H}_2 + \text{CuO} \to \text{Cu} + \text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
$\text{H}_2 + \text{PbO} \to \text{Pb} + \text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
б) $2\text{Al} + 3\text{H}_2\text{SO}_4 \to \text{Al}_2(\text{SO}_4)_3 + 3\text{H}_2\uparrow$. Эта реакция показывает получение водорода.
$3\text{H}_2 + \text{Fe}_2\text{O}_3 \to 2\text{Fe} + 3\text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
$\text{H}_2 + \text{Ag}_2\text{O} \to 2\text{Ag} + \text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
в) $\text{Mg} + 2\text{HCl} \to \text{MgCl}_2 + \text{H}_2\uparrow$. Эта реакция показывает получение водорода.
$4\text{H}_2 + \text{Fe}_3\text{O}_4 \to 3\text{Fe} + 4\text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
$\text{H}_2 + \text{Cu}_2\text{O} \to 2\text{Cu} + \text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
г) $\text{Zn} + \text{H}_2\text{SO}_4 \to \text{ZnSO}_4 + \text{H}_2\uparrow$. Эта реакция показывает получение водорода.
$\text{H}_2 + \text{FeO} \to \text{Fe} + \text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
$4\text{H}_2 + \text{Pb}_3\text{O}_4 \to 3\text{Pb} + 4\text{H}_2\text{O}$. Эта реакция характеризует свойства водорода (восстановительные).
Вывод о получении водорода в лаборатории и его свойствах.
В лабораторных условиях водород получают взаимодействием активных металлов (таких как цинк, алюминий, магний) с разбавленными кислотами. Этот процесс сопровождается выделением газообразного водорода.
Водород является бесцветным газом без запаха. Он значительно легче воздуха, что позволяет собирать его методом вытеснения воздуха (пробирка отверстием вниз). Водород малорастворим в воде.
К химическим свойствам водорода относится его горючесть: при поднесении зажженной спички или лучинки к пробирке с водородом происходит реакция с кислородом воздуха с характерным хлопком и образованием воды. Это также демонстрирует его способность выступать в качестве восстановителя, восстанавливая оксиды металлов до чистых металлов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 7 класс, для упражнения Вариант 1 расположенного на странице 24 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 1 (с. 24), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.













