Вариант 4, страница 14, часть 1 - гдз по химии 7 класс тетрадь для практических работ Борушко

Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 1
Цвет обложки: розовый с колбами
ISBN: 978-985-597-590-9
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 7 классе
Часть 1. Практические работы. Химический эксперимент. Практическая работа 3. Изучение признаков химических реакций и условий их протекания - страница 14.
Вариант 4 (с. 14)
Условие. Вариант 4 (с. 14)
скриншот условия






Вариант __________________ Задание 1, 2, 3(___), 4(___)
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
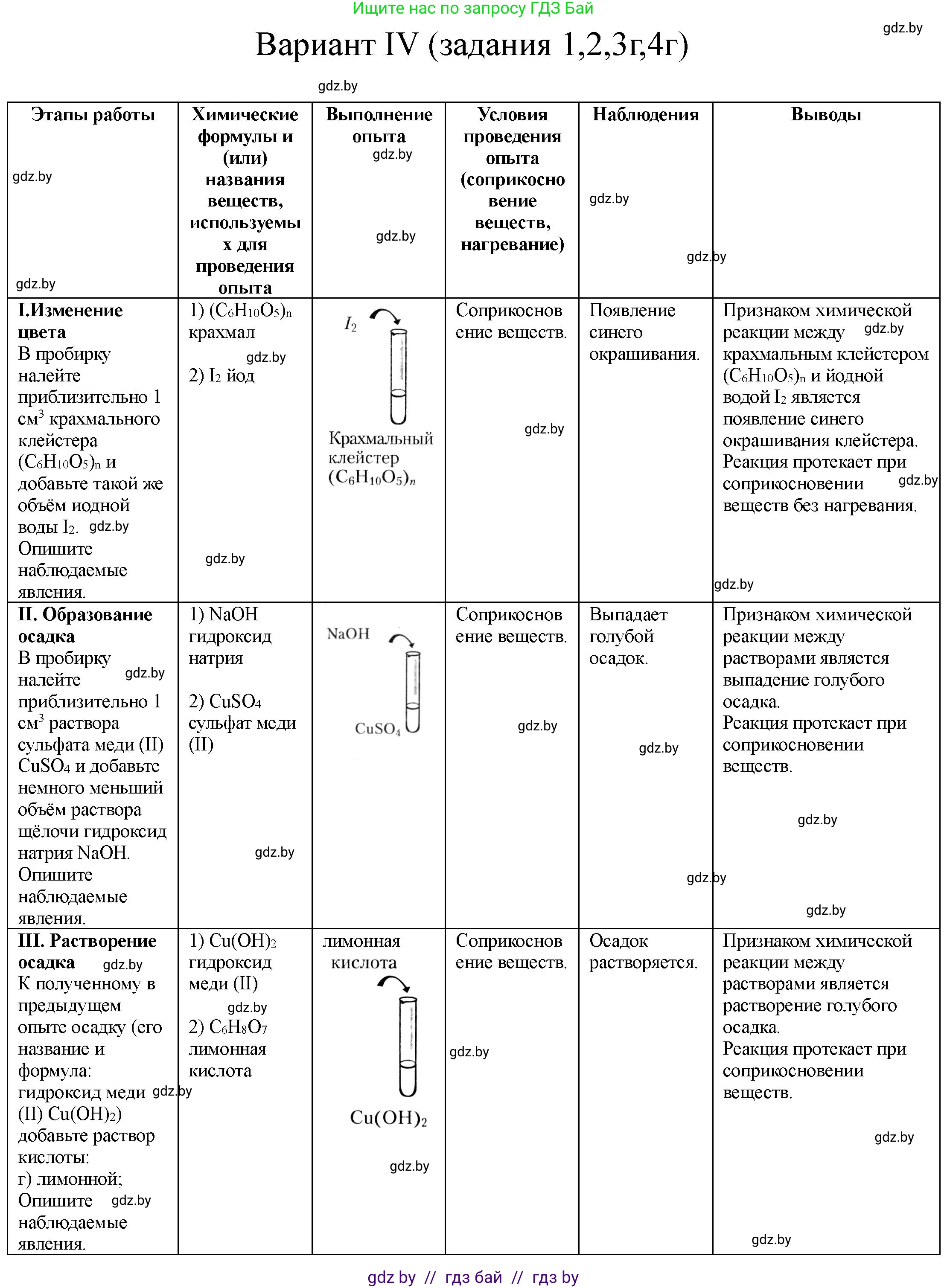
I. Изменение цветаВ пробирку налейте приблизительно 1 $см^3$ крахмального клейстера $(C_6H_{10}O_5)_n$ и добавьте такой же объем иодной воды $I_2$.
Опишите наблюдаемые явления.
1)
2)
$I_2$
Крахмальный клейстер $(C_6H_{10}O_5)_n$
II. Образование осадкаВ пробирку налейте приблизительно 1 $см^3$ раствора сульфата меди(II) $CuSO_4$ и добавьте немного меньший объем раствора щелочи гидроксид натрия $NaOH$.
Опишите наблюдаемые явления.
1)
$NaOH$
2)
$CuSO_4$
Реактивы: свежеприготовленный крахмальный клейстер $(C_6H_{10}O_5)_n$ иодная вода $I_2$, раствор сульфата меди(II) $CuSO_4$, раствор щелочи гидроксид натрия $NaOH$, питьевая сода $NaHCO_3$, раствор одной из кислот: хлороводородной $HCl$, серной $H_2SO_4$, уксусной $CH_3COOH$; лимонной $C_6H_8O_7$.
Условия проведения опыта (соприкосновение веществ, нагревание)
Наблюдения
Выводы
Признаком химической реакции между крахмальным клейстером $(C_6H_{10}O_5)_n$ и иодной водой $I_2$ является
Реакция протекает при соприкосновении веществ без нагревания.
Признаком химической реакции между растворами
Реакция протекает при
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
III. Растворение осадкаК полученному в предыдущем опыте осадку (его название и формула: гидроксид меди(II) $Cu(OH)_2$) добавьте раствор кислоты:
а) хлороводородной;
б) серной;
в) уксусной;
г) лимонной.
Опишите наблюдаемые явления.
1)
кислота
2)
$Cu(OH)_2$
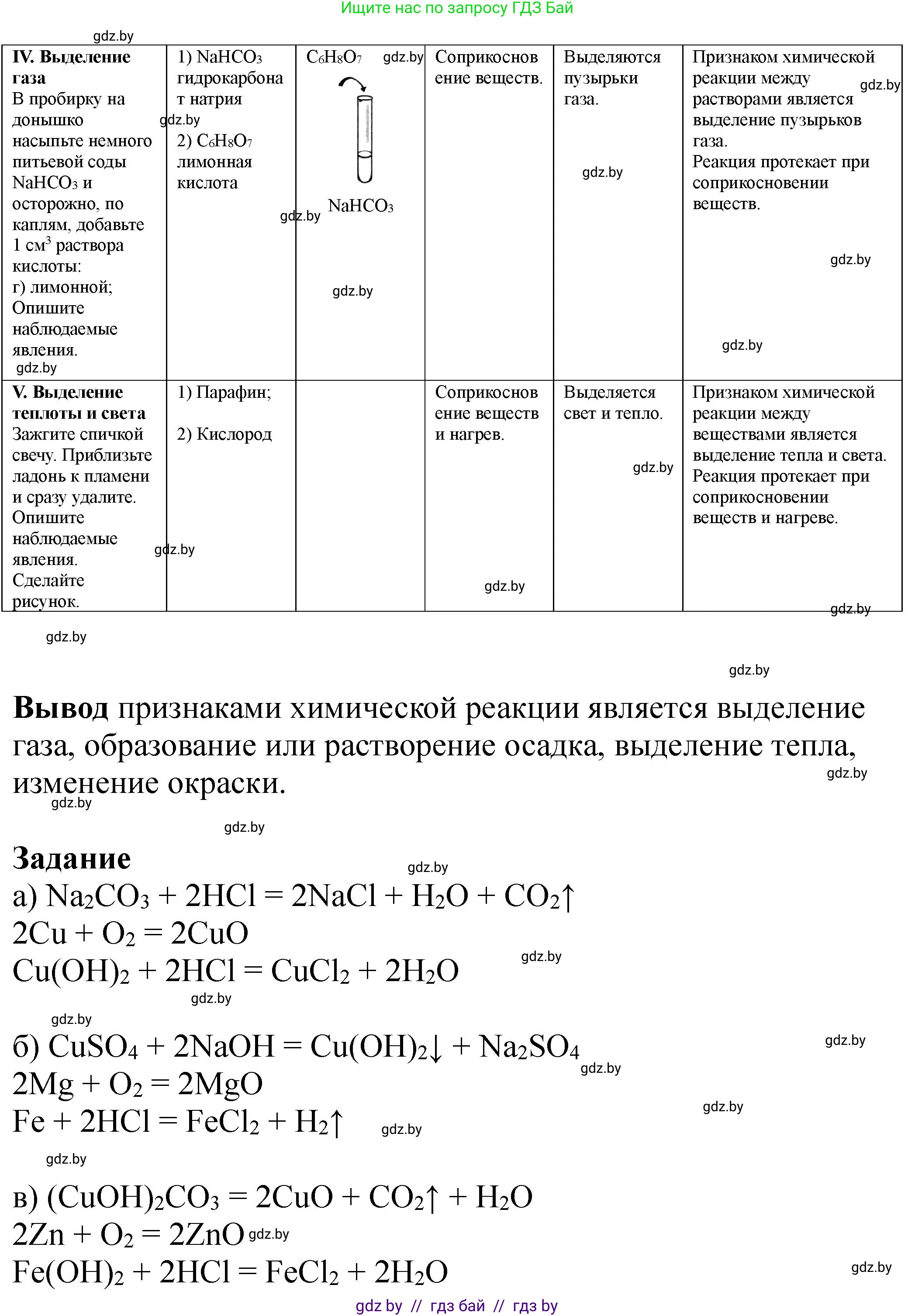
IV. Выделение газаВ пробирку на донышко насыпьте немного питьевой соды $NaHCO_3$ и осторожно, по каплям, добавьте 1 $см^3$ раствора кислоты:
а) хлороводородной;
б) серной;
в) уксусной;
г) лимонной.
Опишите наблюдаемые явления.
1)
2)
Этапы работы
Химические формулы и (или) названия веществ, используемых для проведения опыта
Выполнение опыта
V. Выделение теплоты и светаЗажгите спичкой свечу.
Приблизьте ладонь к пламени и сразу удалите.
Опишите наблюдаемые явления.
Сделайте рисунок.
1) Парафин;
2) кислород
Вывод
*Задание, Расставьте коэффициенты:а) $Na_2CO_3 + HCl = NaCl + H_2O + CO_2\uparrow$
$Cu + O_2 = CuO$
$Cu(OH)_2 + HCl = CuCl_2 + H_2O$
б) $CuSO_4 + NaOH = Cu(OH)_2\downarrow + Na_2SO_4$
$Mg + O_2 = MgO$
$Fe + HCl = FeCl_2 + H_2\uparrow$
в) $(CuOH)_2CO_3 = CuO + CO_2\uparrow + H_2O$
$Zn + O_2 = ZnO$
$Fe(OH)_2 + HCl = FeCl_2 + H_2O$
г) $CuSO_4 + KOH = Cu(OH)_2\downarrow + K_2SO_4$
$Al + Cl_2 = AlCl_3$
$Na_2CO_3 + HCl = NaCl + H_2O + CO_2\uparrow$
Решение. Вариант 4 (с. 14)
Решение 2. Вариант 4 (с. 14)
I. Изменение цвета
| Этапы работы | Химические формулы и (или) названия веществ, используемых для проведения опыта | Выполнение опыта |
|---|---|---|
| В пробирку налейте приблизительно $1 \text{ см}^3$ крахмального клейстера $(\text{C}_6\text{H}_{10}\text{O}_5)_n$ и добавьте такой же объем иодной воды $\text{I}_2$. Опишите наблюдаемые явления. | 1) Крахмальный клейстер $(\text{C}_6\text{H}_{10}\text{O}_5)_n$ 2) Иодная вода $\text{I}_2$ |
| Условия проведения опыта (соприкосновение веществ, нагревание) | Наблюдения | Выводы |
|---|---|---|
| Соприкосновение веществ без нагревания. | При добавлении иодной воды к крахмальному клейстеру наблюдается появление синего, почти черного, окрашивания. | Признаком химической реакции между крахмальным клейстером $(\text{C}_6\text{H}_{10}\text{O}_5)_n$ и иодной водой $\text{I}_2$ является изменение цвета (появление синего/сине-фиолетового окрашивания). Реакция протекает при соприкосновении веществ без нагревания. |
II. Образование осадка
| Этапы работы | Химические формулы и (или) названия веществ, используемых для проведения опыта | Выполнение опыта |
|---|---|---|
| В пробирку налейте приблизительно $1 \text{ см}^3$ раствора сульфата меди(II) $\text{CuSO}_4$ и добавьте немного меньший объем раствора щелочи гидроксид натрия $\text{NaOH}$. Опишите наблюдаемые явления. | 1) Сульфат меди(II) $\text{CuSO}_4$ 2) Гидроксид натрия $\text{NaOH}$ |
| Условия проведения опыта (соприкосновение веществ, нагревание) | Наблюдения | Выводы |
|---|---|---|
| Соприкосновение веществ без нагревания. | При смешивании растворов сульфата меди(II) и гидроксида натрия образуется голубой студенистый осадок гидроксида меди(II). | Признаком химической реакции между растворами $\text{CuSO}_4$ и $\text{NaOH}$ является образование голубого студенистого осадка. Реакция протекает при соприкосновении веществ без нагревания. |
III. Растворение осадка
| Этапы работы | Химические формулы и (или) названия веществ, используемых для проведения опыта | Выполнение опыта |
|---|---|---|
| К полученному в предыдущем опыте осадку (его название и формула: гидроксид меди(II) $\text{Cu(OH)}_2$) добавьте раствор кислоты: а) хлороводородной; б) серной; в) уксусной; г) лимонной. Опишите наблюдаемые явления. | 1) Гидроксид меди(II) $\text{Cu(OH)}_2$ 2) Хлороводородная кислота $\text{HCl}$ (пример) |
| Условия проведения опыта (соприкосновение веществ, нагревание) | Наблюдения | Выводы |
|---|---|---|
| Соприкосновение веществ без нагревания. | При добавлении кислоты к голубому осадку гидроксида меди(II) осадок растворяется, образуя прозрачный раствор соли меди соответствующей кислоты (например, хлорида меди(II) сине-зеленого цвета). | Признаком химической реакции между гидроксидом меди(II) и кислотой является растворение осадка и образование раствора. Реакция протекает при соприкосновении веществ без нагревания. |
IV. Выделение газа
| Этапы работы | Химические формулы и (или) названия веществ, используемых для проведения опыта | Выполнение опыта |
|---|---|---|
| В пробирку на донышко насыпьте немного питьевой соды $\text{NaHCO}_3$ и осторожно, по каплям, добавьте $1 \text{ см}^3$ раствора кислоты: а) хлороводородной; б) серной; в) уксусной; г) лимонной. Опишите наблюдаемые явления. | 1) Гидрокарбонат натрия $\text{NaHCO}_3$ 2) Хлороводородная кислота $\text{HCl}$ (пример) |
| Условия проведения опыта (соприкосновение веществ, нагревание) | Наблюдения | Выводы |
|---|---|---|
| Соприкосновение веществ без нагревания. | При добавлении кислоты к питьевой соде наблюдается бурное выделение газа (углекислого газа), раствор пенится. | Признаком химической реакции между гидрокарбонатом натрия и кислотой является выделение газа. Реакция протекает при соприкосновении веществ без нагревания. |
Ответ:
V. Выделение теплоты и света
| Этапы работы | Химические формулы и (или) названия веществ, используемых для проведения опыта | Выполнение опыта |
|---|---|---|
| Зажгите спичкой свечу. Приблизьте ладонь к пламени и сразу удалите. Опишите наблюдаемые явления. Сделайте рисунок. | 1) Парафин (например, $\text{C}_{25}\text{H}_{52}$) 2) Кислород $\text{O}_2$ |
| Условия проведения опыта (соприкосновение веществ, нагревание) | Наблюдения | Выводы |
|---|---|---|
| Начальное нагревание (поджигание), затем самоподдерживающееся горение. | При горении свечи наблюдается яркое пламя (выделение света) и ощущается тепло (выделение теплоты). Парафин плавится и сгорает. | Признаком химической реакции горения парафина является выделение теплоты и света. Реакция протекает при контакте веществ (парафин и кислород) и требует начального нагревания (поджигания), после чего самоподдерживается. |
Ответ:
Задание, Расставьте коэффициенты:
а) $ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
$ 2\text{Cu} + \text{O}_2 = 2\text{CuO} $
$ \text{Cu(OH)}_2 + 2\text{HCl} = \text{CuCl}_2 + 2\text{H}_2\text{O} $
б) $ \text{CuSO}_4 + 2\text{NaOH} = \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4 $
$ 2\text{Mg} + \text{O}_2 = 2\text{MgO} $
$ \text{Fe} + 2\text{HCl} = \text{FeCl}_2 + \text{H}_2\uparrow $
в) $ \text{Cu}_2(\text{OH})_2\text{CO}_3 = 2\text{CuO} + \text{CO}_2\uparrow + \text{H}_2\text{O} $
$ 2\text{Zn} + \text{O}_2 = 2\text{ZnO} $
$ \text{Fe(OH)}_2 + 2\text{HCl} = \text{FeCl}_2 + 2\text{H}_2\text{O} $
г) $ \text{CuSO}_4 + 2\text{KOH} = \text{Cu(OH)}_2\downarrow + \text{K}_2\text{SO}_4 $
$ 2\text{Al} + 3\text{Cl}_2 = 2\text{AlCl}_3 $
$ \text{Na}_2\text{CO}_3 + 2\text{HCl} = 2\text{NaCl} + \text{H}_2\text{O} + \text{CO}_2\uparrow $
Ответ:
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 7 класс, для упражнения Вариант 4 расположенного на странице 14 для 1-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 4 (с. 14), автора: Борушко (Ирина Ивановна), 1-й части учебного пособия издательства Сэр-Вит.













