Номер 727, страница 164 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 3. Кислородсодержащие органические соединения. 3.5. Сложные эфиры. Жиры - номер 727, страница 164.
№727 (с. 164)
Условие. №727 (с. 164)
скриншот условия

727. Смесь фенола и метилового эфира одноосновной карбоновой кислоты (масса смеси $83,6 \text{ г}$) разделили на две равные части. Одна часть может полностью прореагировать с $94,9 \text{ см}^3$ $20\%$-ного по массе раствора гидроксида калия (плотность $1,18 \text{ г}/\text{см}^3$). При обработке другой части избытком бромной воды образуется $99,3 \text{ г}$ осадка. Определите строение сложного эфира и его массовую долю в смеси.
Решение. №727 (с. 164)

Решение 2. №727 (с. 164)
Дано:
$m(\text{смеси}) = 83,6 \text{ г}$
$V(\text{р-ра } KOH) = 94,9 \text{ см}^3$
$\omega(KOH) = 20\% = 0,2$
$\rho(\text{р-ра } KOH) = 1,18 \text{ г/см}^3$
$m(\text{осадка}) = 99,3 \text{ г}$
Смесь: фенол ($C_6H_5OH$) и метиловый эфир одноосновной карбоновой кислоты ($RCOOCH_3$).
Найти:
1. Строение сложного эфира.
2. $\omega(\text{эфира})$ в смеси.
Решение:
1. Исходную смесь разделили на две равные части. Найдем массу одной части смеси:
$m(\text{1 части}) = \frac{m(\text{смеси})}{2} = \frac{83,6 \text{ г}}{2} = 41,8 \text{ г}$
2. Вторую часть смеси обработали избытком бромной воды. С бромом реагирует только фенол, образуя белый осадок 2,4,6-трибромфенола. Сложный эфир насыщенной или ароматической карбоновой кислоты с бромной водой не реагирует.
Уравнение реакции:
$C_6H_5OH + 3Br_2 \rightarrow C_6H_2Br_3OH \downarrow + 3HBr$
Найдем молярную массу осадка ($C_6H_2Br_3OH$):
$M(C_6H_2Br_3OH) = 6 \cdot 12 + 3 \cdot 1 + 3 \cdot 80 + 16 = 331 \text{ г/моль}$
Найдем количество вещества осадка:
$n(C_6H_2Br_3OH) = \frac{m}{M} = \frac{99,3 \text{ г}}{331 \text{ г/моль}} = 0,3 \text{ моль}$
По уравнению реакции, количество вещества фенола равно количеству вещества трибромфенола:
$n(C_6H_5OH) = n(C_6H_2Br_3OH) = 0,3 \text{ моль}$
Найдем массу фенола в одной части смеси:
$M(C_6H_5OH) = 6 \cdot 12 + 6 \cdot 1 + 16 = 94 \text{ г/моль}$
$m(C_6H_5OH) = n \cdot M = 0,3 \text{ моль} \cdot 94 \text{ г/моль} = 28,2 \text{ г}$
3. Первую часть смеси обработали раствором гидроксида калия. С $KOH$ реагируют и фенол (как кислота), и сложный эфир (гидролиз).
Найдем массу и количество вещества $KOH$ в растворе:
$m(\text{р-ра } KOH) = V \cdot \rho = 94,9 \text{ см}^3 \cdot 1,18 \text{ г/см}^3 = 111,982 \text{ г}$
$m(KOH) = m(\text{р-ра}) \cdot \omega(KOH) = 111,982 \text{ г} \cdot 0,2 = 22,3964 \text{ г}$
$M(KOH) = 39 + 16 + 1 = 56 \text{ г/моль}$
$n(KOH)_{\text{общ}} = \frac{m}{M} = \frac{22,3964 \text{ г}}{56 \text{ г/моль}} \approx 0,4 \text{ моль}$
Уравнения реакций:
$C_6H_5OH + KOH \rightarrow C_6H_5OK + H_2O$
$RCOOCH_3 + KOH \rightarrow RCOOK + CH_3OH$
Количество $KOH$, прореагировавшего с фенолом:
$n(KOH)_{\text{на фенол}} = n(C_6H_5OH) = 0,3 \text{ моль}$
Количество $KOH$, прореагировавшего со сложным эфиром:
$n(KOH)_{\text{на эфир}} = n(KOH)_{\text{общ}} - n(KOH)_{\text{на фенол}} = 0,4 - 0,3 = 0,1 \text{ моль}$
По уравнению реакции гидролиза, количество вещества сложного эфира равно количеству вещества $KOH$, пошедшего на эту реакцию:
$n(\text{эфира}) = n(KOH)_{\text{на эфир}} = 0,1 \text{ моль}$
4. Найдем массу сложного эфира в одной части смеси:
$m(\text{эфира}) = m(\text{1 части}) - m(C_6H_5OH) = 41,8 \text{ г} - 28,2 \text{ г} = 13,6 \text{ г}$
Теперь можем найти молярную массу сложного эфира:
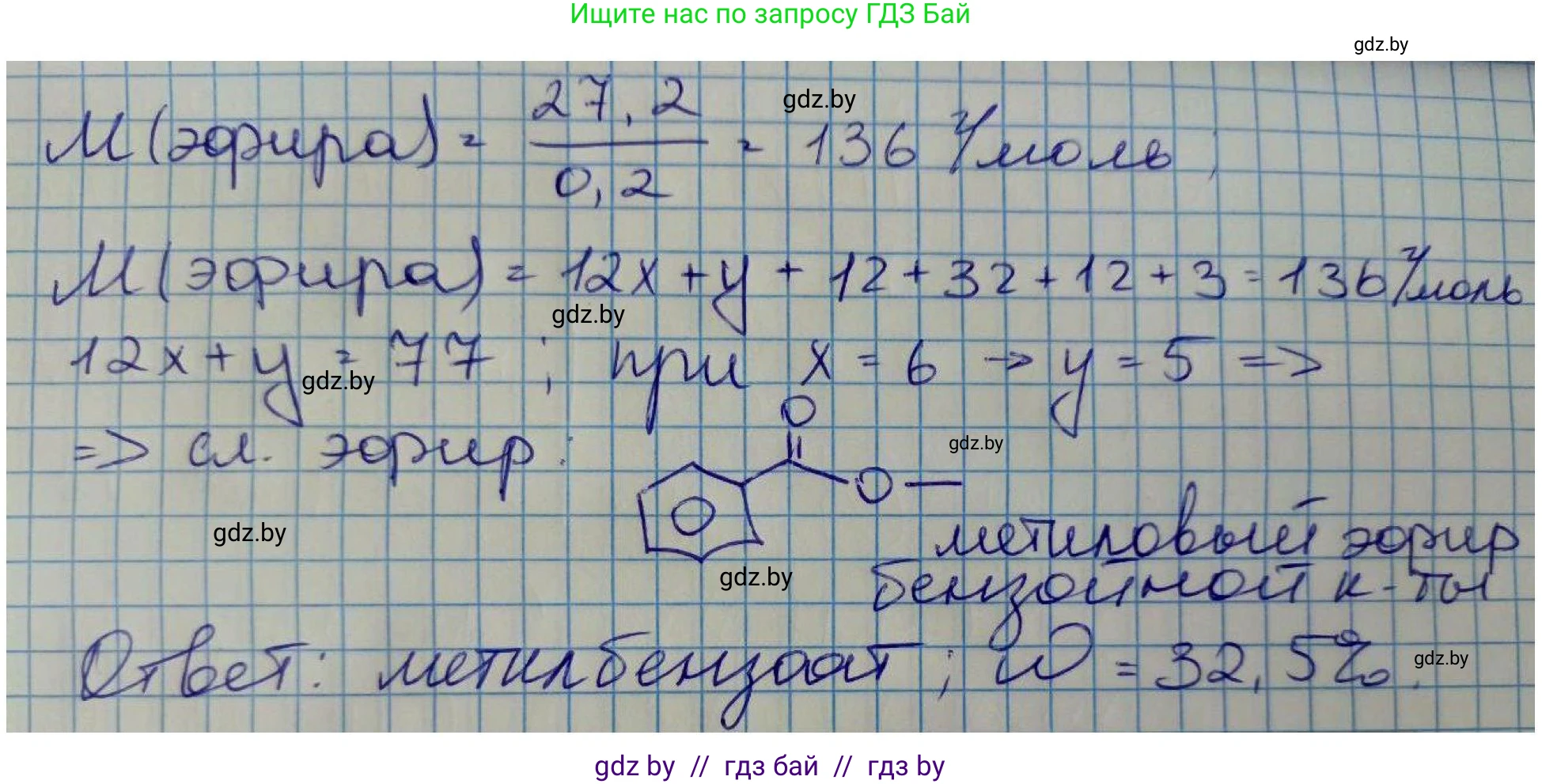
$M(\text{эфира}) = \frac{m(\text{эфира})}{n(\text{эфира})} = \frac{13,6 \text{ г}}{0,1 \text{ моль}} = 136 \text{ г/моль}$
Общая формула метилового эфира карбоновой кислоты $RCOOCH_3$. Его молярная масса:
$M(RCOOCH_3) = M(R) + M(C) + 2 \cdot M(O) + M(CH_3) = M(R) + 12 + 2 \cdot 16 + 15 = M(R) + 59 \text{ г/моль}$
$M(R) + 59 = 136$
$M(R) = 136 - 59 = 77 \text{ г/моль}$
Углеводородный радикал с молярной массой 77 г/моль - это фенил $C_6H_5$:
$M(C_6H_5) = 6 \cdot 12 + 5 \cdot 1 = 77 \text{ г/моль}$
Следовательно, кислота - бензойная ($C_6H_5COOH$), а сложный эфир - метилбензоат ($C_6H_5COOCH_3$). Его структурная формула:

5. Найдем массовую долю метилбензоата в исходной смеси. Состав частей одинаков, поэтому расчет можно вести по одной части.
$\omega(\text{эфира}) = \frac{m(\text{эфира})}{m(\text{1 части})} = \frac{13,6 \text{ г}}{41,8 \text{ г}} \approx 0,32536$
В процентах: $\omega(\text{эфира}) = 0,32536 \cdot 100\% \approx 32,54\%$
Ответ:
Строение сложного эфира - метилбензоат, $C_6H_5COOCH_3$. Массовая доля сложного эфира в смеси составляет $32,54\%$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 727 расположенного на странице 164 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №727 (с. 164), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














