Номер 752, страница 171 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 3. Кислородсодержащие органические соединения. 3.5. Сложные эфиры. Жиры - номер 752, страница 171.
№752 (с. 171)
Условие. №752 (с. 171)
скриншот условия
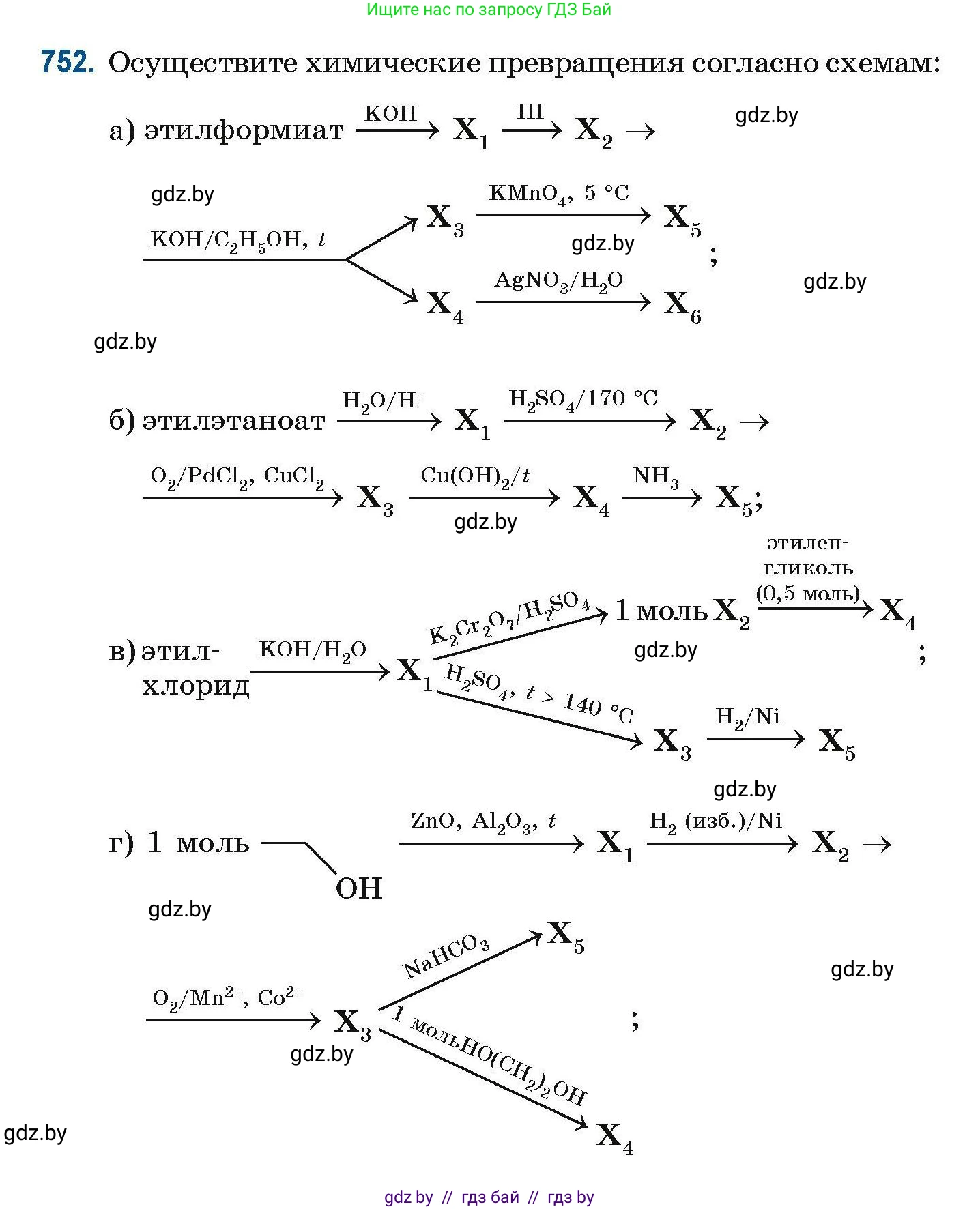
752. Осуществите химические превращения согласно схемам:
а) этилформиат
этилформиат $\xrightarrow{\text{KOH}} \text{X}_1 \xrightarrow{\text{HI}} \text{X}_2 \rightarrow$
этилформиат $\xrightarrow{\text{KOH/C}_2\text{H}_5\text{OH}, t} \text{X}_3 \xrightarrow{\text{KMnO}_4, 5 \, \text{°C}} \text{X}_5 \, ;$
этилформиат $\xrightarrow{\text{AgNO}_3/\text{H}_2\text{O}} \text{X}_6$
б) этилэтаноат
этилэтаноат $\xrightarrow{\text{H}_2\text{O/H}^{+}} \text{X}_1 \xrightarrow{\text{H}_2\text{SO}_4/170 \, \text{°C}} \text{X}_2 \rightarrow$
этилэтаноат $\xrightarrow{\text{O}_2/\text{PdCl}_2, \text{CuCl}_2} \text{X}_3 \xrightarrow{\text{Cu(OH)}_2/t} \text{X}_4 \xrightarrow{\text{NH}_3} \text{X}_5 \, ;$
в) этилхлорид
этилхлорид $\xrightarrow{\text{KOH/H}_2\text{O}} \text{X}_1$
$\text{X}_1 \xrightarrow{\text{K}_2\text{Cr}_2\text{O}_7/\text{H}_2\text{SO}_4} 1 \text{ моль } \text{X}_2 \xrightarrow{\substack{\text{этилен-} \\ \text{гликоль} \\ (0,5 \text{ моль})}} \text{X}_4 \, ;$
$\text{X}_1 \xrightarrow{\text{H}_2\text{SO}_4, t > 140 \, \text{°C}} \text{X}_3 \xrightarrow{\text{H}_2/\text{Ni}} \text{X}_5 \, ;$
г) 1 моль
1 моль $\rightarrow$ OH $\xrightarrow{\text{ZnO}, \text{Al}_2\text{O}_3, t} \text{X}_1 \xrightarrow{\text{H}_2 \text{(изб.)}/\text{Ni}} \text{X}_2 \rightarrow$
$\xrightarrow{\text{O}_2/\text{Mn}^{2+}, \text{Co}^{2+}} \text{X}_3$
$\text{X}_3 \xrightarrow{\text{NaHCO}_3} \text{X}_5$
$\text{X}_3 \xrightarrow{1 \text{ моль HO(CH}_2)_2\text{OH}} \text{X}_4 \, ;$
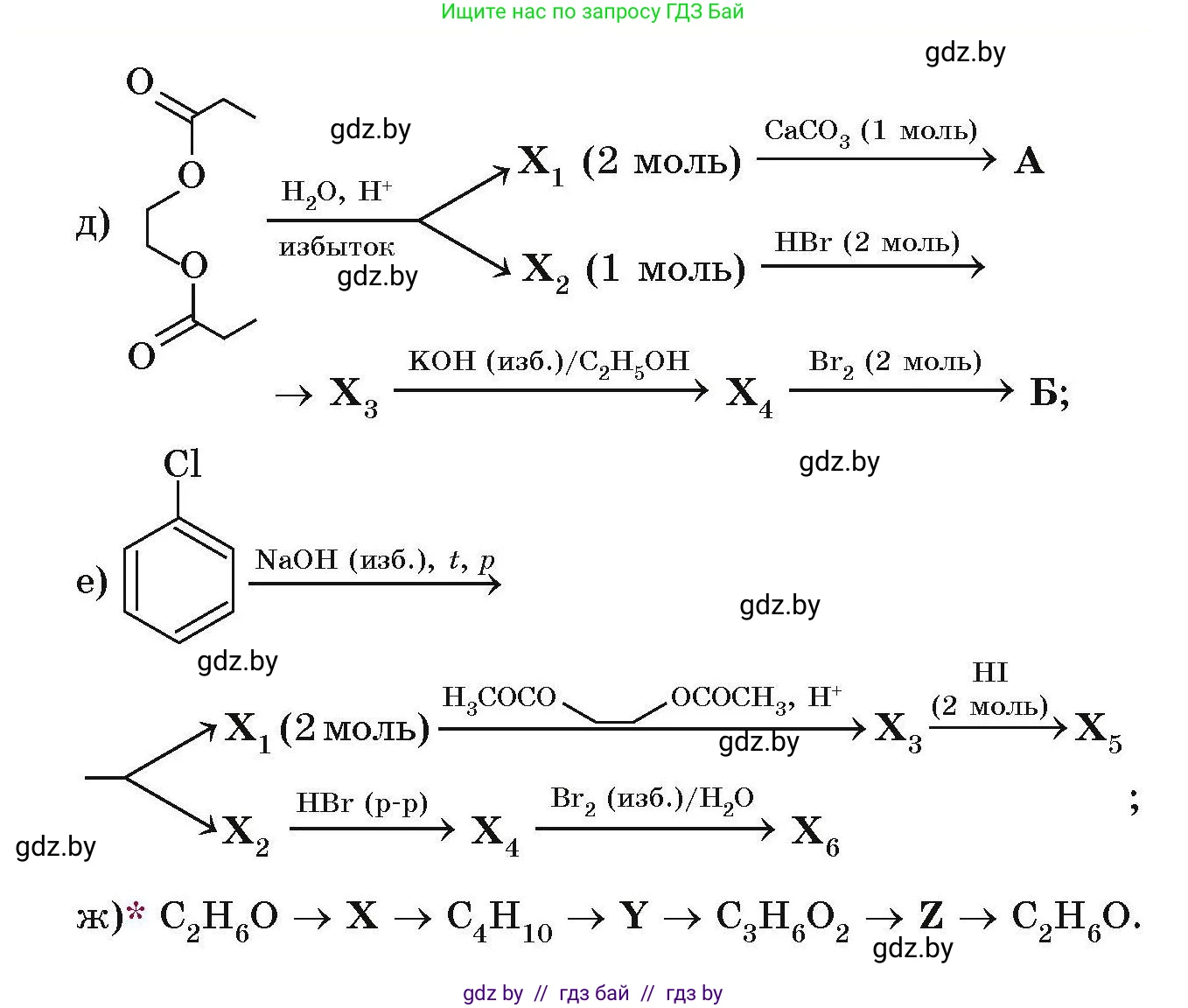
д) $\text{CH}_3\text{CH}_2\text{COOCH}_2\text{CH}_2\text{CH}_2\text{OCOCH}_2\text{CH}_3 \xrightarrow{\text{H}_2\text{O, H}^{+}} \substack{\text{избыток}}$
$\text{X}_1 \text{ (2 моль)} \xrightarrow{\text{CaCO}_3 \text{ (1 моль)}} \text{A}$
$\text{X}_2 \text{ (1 моль)} \xrightarrow{\text{HBr (2 моль)}} \rightarrow$
$\text{CH}_3\text{CH}_2\text{COOCH}_2\text{CH}_2\text{CH}_2\text{OCOCH}_2\text{CH}_3 \xrightarrow{\text{KOH (изб.)/C}_2\text{H}_5\text{OH}} \text{X}_3 \xrightarrow{\text{Br}_2 \text{ (2 моль)}} \text{X}_4 \xrightarrow{} \text{Б};$
е) $\text{C}_6\text{H}_5\text{Cl} \xrightarrow{\text{NaOH (изб.), } t, p} \text{Y}$
$\text{Y} \rightarrow \text{X}_1 \text{ (2 моль)} \xrightarrow{(\text{CH}_3\text{CO})_2\text{O, H}^{+}} \text{X}_3 \xrightarrow{\text{HI (2 моль)}} \text{X}_5$
$\text{Y} \rightarrow \text{X}_2 \xrightarrow{\text{HBr (p-p)}} \text{X}_4 \xrightarrow{\text{Br}_2 \text{ (изб.)}/\text{H}_2\text{O}} \text{X}_6 \, ;$
ж) *
$\text{C}_2\text{H}_6\text{O} \rightarrow \text{X} \rightarrow \text{C}_4\text{H}_{10} \rightarrow \text{Y} \rightarrow \text{C}_3\text{H}_6\text{O}_2 \rightarrow \text{Z} \rightarrow \text{C}_2\text{H}_6\text{O}.$
Решение. №752 (с. 171)

Решение 2. №752 (с. 171)
а) этилформиат
Решение
Исходное вещество – этилформиат, `$HCOOC_2H_5$`.
1. Гидролиз этилформиата водным раствором гидроксида калия (омыление):
`$HCOOC_2H_5 + KOH \rightarrow HCOOK (X_1) + C_2H_5OH$`
Вещество `$X_1$` – формиат калия (`$HCOOK$`).
2. Реакция формиата калия с иодоводородной кислотой:
`$HCOOK + HI \rightarrow HCOOH (X_2) + KI$`
Вещество `$X_2$` – муравьиная кислота (`$HCOOH$`).
3. Вторая ветвь превращений исходит из продуктов гидролиза этилформиата спиртовым раствором КОН. Продукты те же: этанол и формиат калия. Исходя из последующих реакций, распределим продукты:
`$X_3$` – этанол (`$C_2H_5OH$`).
`$X_4$` – формиат калия (`$HCOOK$`).
4. Мягкое окисление этанола (`$X_3$`) перманганатом калия в нейтральной среде при низкой температуре приводит к образованию ацетальдегида:
`$3C_2H_5OH + 2KMnO_4 \xrightarrow{5^\circ C} 3CH_3CHO (X_5) + 2MnO_2\downarrow + 2KOH + 2H_2O$`
Вещество `$X_5$` – этаналь (уксусный альдегид) (`$CH_3CHO$`).
5. Формиат калия (`$X_4$`), как и муравьиная кислота, обладает восстановительными свойствами (содержит альдегидную группу в скрытом виде) и может вступать в реакцию "серебряного зеркала". В реакции с нитратом серебра он восстанавливает серебро:
`$HCOOK + 2AgNO_3 + 2NH_4OH \rightarrow (NH_4)_2CO_3 + 2Ag\downarrow (X_6) + 2NH_4NO_3 + KNO_3 + H_2O$`. (В условии не указан аммиак, но реакция идет в слабощелочной среде раствора соли).
Вещество `$X_6$` – металлическое серебро (`$Ag$`).
Ответ: `$X_1$` – `$HCOOK$` (формиат калия), `$X_2$` – `$HCOOH$` (муравьиная кислота), `$X_3$` – `$C_2H_5OH$` (этанол), `$X_4$` – `$HCOOK$` (формиат калия), `$X_5$` – `$CH_3CHO$` (этаналь), `$X_6$` – `$Ag$` (серебро).
б) этилэтаноат
Решение
Исходное вещество – этилэтаноат (этиловый эфир уксусной кислоты), `$CH_3COOC_2H_5$`.
1. Кислотный гидролиз этилэтаноата. Продуктами являются уксусная кислота и этанол. Судя по следующей реакции (дегидратация), `$X_1$` – это этанол.
`$CH_3COOC_2H_5 + H_2O \stackrel{H^+}{\rightleftharpoons} CH_3COOH + C_2H_5OH (X_1)$`
Вещество `$X_1$` – этанол (`$C_2H_5OH$`).
2. Внутримолекулярная дегидратация этанола при нагревании с концентрированной серной кислотой:
`$C_2H_5OH \xrightarrow{H_2SO_4, 170^\circ C} CH_2=CH_2 (X_2) + H_2O$`
Вещество `$X_2$` – этен (этилен) (`$CH_2=CH_2$`).
3. Следующая стрелка, вероятно, исходит от `$X_2$` (этена), так как указанные реагенты (`$O_2/PdCl_2, CuCl_2$`) соответствуют процессу Ваккера – окислению алкенов:
`$2CH_2=CH_2 + O_2 \xrightarrow{PdCl_2, CuCl_2} 2CH_3CHO (X_3)$`
Вещество `$X_3$` – этаналь (уксусный альдегид) (`$CH_3CHO$`).
4. Окисление этаналя гидроксидом меди(II) при нагревании:
`$CH_3CHO + 2Cu(OH)_2 \xrightarrow{t} CH_3COOH (X_4) + Cu_2O\downarrow + 2H_2O$`
Вещество `$X_4$` – уксусная кислота (`$CH_3COOH$`).
5. Реакция уксусной кислоты с аммиаком:
`$CH_3COOH + NH_3 \rightarrow CH_3COONH_4 (X_5)$`
Вещество `$X_5$` – ацетат аммония (`$CH_3COONH_4$`).
Ответ: `$X_1$` – `$C_2H_5OH$` (этанол), `$X_2$` – `$C_2H_4$` (этен), `$X_3$` – `$CH_3CHO$` (этаналь), `$X_4$` – `$CH_3COOH$` (уксусная кислота), `$X_5$` – `$CH_3COONH_4$` (ацетат аммония).
в) этилхлорид
Решение
Исходное вещество – этилхлорид, `$C_2H_5Cl$`.
1. Щелочной гидролиз этилхлорида:
`$C_2H_5Cl + KOH_{ (водн.) } \rightarrow C_2H_5OH (X_1) + KCl$`
Вещество `$X_1$` – этанол (`$C_2H_5OH$`).
2. Окисление этанола (`$X_1$`) дихроматом калия в кислой среде. Первичные спирты окисляются до карбоновых кислот:
`$3C_2H_5OH + 2K_2Cr_2O_7 + 8H_2SO_4 \rightarrow 3CH_3COOH (X_2) + 2Cr_2(SO_4)_3 + 2K_2SO_4 + 11H_2O$`
Вещество `$X_2$` – уксусная кислота (`$CH_3COOH$`).
3. Реакция этерификации между уксусной кислотой (`$X_2$`) и этиленгликолем (`$HOCH_2CH_2OH$`). Указано соотношение 1 моль кислоты и 0.5 моль диола, что соответствует мольному соотношению 2:1. Образуется сложный диэфир:
`$2CH_3COOH + HOCH_2CH_2OH \stackrel{H^+}{\rightleftharpoons} CH_3COOCH_2CH_2OCOCH_3 (X_4) + 2H_2O$`
Вещество `$X_4$` – этиленгликольдиацетат.
4. Внутримолекулярная дегидратация этанола (`$X_1$`) при температуре выше 140 °C:
`$C_2H_5OH \xrightarrow{H_2SO_4, t > 140^\circ C} CH_2=CH_2 (X_3) + H_2O$`
Вещество `$X_3$` – этен (`$C_2H_4$`).
5. Гидрирование этена на никелевом катализаторе:
`$CH_2=CH_2 + H_2 \xrightarrow{Ni} CH_3-CH_3 (X_5)$`
Вещество `$X_5$` – этан (`$C_2H_6$`).
Ответ: `$X_1$` – `$C_2H_5OH$` (этанол), `$X_2$` – `$CH_3COOH$` (уксусная кислота), `$X_3$` – `$C_2H_4$` (этен), `$X_4$` – `$CH_3COOCH_2CH_2OCOCH_3$` (этиленгликольдиацетат), `$X_5$` – `$C_2H_6$` (этан).
г) 1 моль пропанол-1
Решение
Исходное вещество – пропанол-1, `$CH_3CH_2CH_2OH$`.
1. Каталитическая дегидратация пропанола-1:
`$CH_3CH_2CH_2OH \xrightarrow{ZnO, Al_2O_3, t} CH_3-CH=CH_2 (X_1) + H_2O$`
Вещество `$X_1$` – пропен (`$CH_3-CH=CH_2$`).
2. Гидрирование пропена в избытке водорода:
`$CH_3-CH=CH_2 + H_2 \xrightarrow{Ni} CH_3-CH_2-CH_3 (X_2)$`
Вещество `$X_2$` – пропан (`$CH_3CH_2CH_3$`).
3. Каталитическое окисление пропанола-1 кислородом воздуха в присутствии солей марганца или кобальта приводит к образованию пропановой кислоты:
`$CH_3CH_2CH_2OH + O_2 \xrightarrow{Mn^{2+}, Co^{2+}} CH_3CH_2COOH (X_3) + H_2O$`
Вещество `$X_3$` – пропановая кислота (`$CH_3CH_2COOH$`).
4. Реакция пропановой кислоты (`$X_3$`) с гидрокарбонатом натрия:
`$CH_3CH_2COOH + NaHCO_3 \rightarrow CH_3CH_2COONa (X_5) + H_2O + CO_2\uparrow$`
Вещество `$X_5$` – пропионат натрия (`$CH_3CH_2COONa$`).
5. Реакция этерификации между пропановой кислотой (`$X_3$`) и этиленгликолем (`$HOCH_2CH_2OH$`). При эквимолярном соотношении реагентов преимущественно образуется моноэфир:
`$CH_3CH_2COOH + HOCH_2CH_2OH \stackrel{H^+}{\rightleftharpoons} CH_3CH_2COOCH_2CH_2OH (X_4) + H_2O$`
Вещество `$X_4$` – 2-гидроксиэтилпропионат.
Ответ: `$X_1$` – `$CH_3-CH=CH_2$` (пропен), `$X_2$` – `$CH_3CH_2CH_3$` (пропан), `$X_3$` – `$CH_3CH_2COOH$` (пропановая кислота), `$X_4$` – `$CH_3CH_2COOCH_2CH_2OH$` (2-гидроксиэтилпропионат), `$X_5$` – `$CH_3CH_2COONa$` (пропионат натрия).
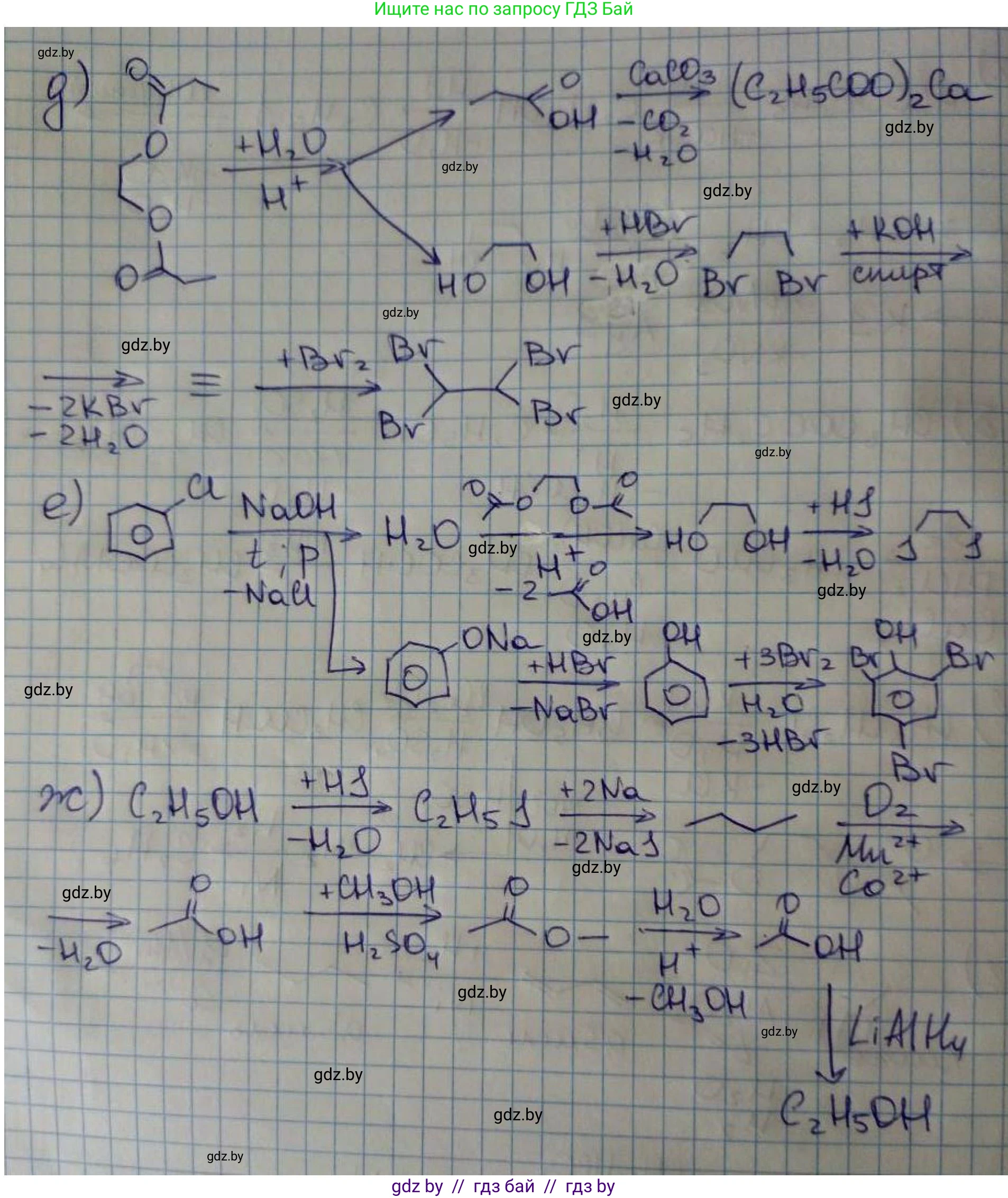
д)
Решение
Исходное вещество – этилендипропионат, `$CH_3CH_2COOCH_2CH_2OCOCH_2CH_3$`.
1. Кислотный гидролиз сложного диэфира в избытке воды:
`$CH_3CH_2COOCH_2CH_2OCOCH_2CH_3 + 2H_2O \stackrel{H^+}{\rightleftharpoons} 2CH_3CH_2COOH (X_1) + HOCH_2CH_2OH (X_2)$`
Вещество `$X_1$` – пропановая кислота (`$CH_3CH_2COOH$`).
Вещество `$X_2$` – этиленгликоль (`$HOCH_2CH_2OH$`).
2. Реакция пропановой кислоты (`$X_1$`) с карбонатом кальция:
`$2CH_3CH_2COOH + CaCO_3 \rightarrow (CH_3CH_2COO)_2Ca (A) + H_2O + CO_2\uparrow$`
Вещество `$A$` – пропионат кальция (`$(CH_3CH_2COO)_2Ca$`).
3. Реакция этиленгликоля (`$X_2$`) с бромоводородом. Происходит замещение обеих гидроксильных групп:
`$HOCH_2CH_2OH + 2HBr \rightarrow BrCH_2CH_2Br (X_3) + 2H_2O$`
Вещество `$X_3$`, которое вступает в следующую реакцию, – это 1,2-дибромэтан (`$BrCH_2CH_2Br$`).
4. Дегидрогалогенирование 1,2-дибромэтана избытком спиртового раствора щелочи:
`$BrCH_2CH_2Br + 2KOH_{ (спирт.) } \xrightarrow{t} HC\equiv CH (X_4) + 2KBr + 2H_2O$`
Вещество `$X_4$` – ацетилен (этин) (`$HC\equiv CH$`).
5. Присоединение двух молей брома к ацетилену:
`$HC\equiv CH + 2Br_2 \rightarrow Br_2CH-CHBr_2 (\text{Б})$`
Вещество `$\text{Б}$` – 1,1,2,2-тетрабромэтан (`$C_2H_2Br_4$`).
Ответ: `$X_1$` – `$CH_3CH_2COOH$` (пропановая кислота), `$X_2$` – `$HOCH_2CH_2OH$` (этиленгликоль), `$A$` – `$(CH_3CH_2COO)_2Ca$` (пропионат кальция), `$X_3$` – `$BrCH_2CH_2Br$` (1,2-дибромэтан), `$X_4$` – `$HC\equiv CH$` (этин), `$\text{Б}$` – `$Br_2CH-CHBr_2$` (1,1,2,2-тетрабромэтан).
е) хлорбензол
Решение
Схема для этого пункта неоднозначна. Приводим одно из возможных решений, основанное на химически правдоподобных превращениях.
Исходное вещество – хлорбензол, `$C_6H_5Cl$`.
1. Взаимодействие хлорбензола с избытком NaOH при высокой температуре и давлении (процесс Доу) приводит к образованию фенолята натрия:
`$C_6H_5Cl + 2NaOH \xrightarrow{t, p} C_6H_5ONa + NaCl + H_2O$`
Продукт, от которого идут дальнейшие превращения, – фенолят натрия (`$C_6H_5ONa$`).
Цепочка 1 (получение `$X_5$`):
2. Предположим, что `$X_1$` – это фенолят натрия. Реагент для получения `$X_3$` неясен; предположим, что это дихлорметан (`$CH_2Cl_2$`), который реагирует с двумя молями фенолята (реакция Вильямсона):
`$2C_6H_5ONa (X_1) + CH_2Cl_2 \rightarrow C_6H_5-O-CH_2-O-C_6H_5 (X_3) + 2NaCl$`
Вещество `$X_3$` – бис(фенокси)метан.
3. Расщепление простого эфира `$X_3$` иодоводородом. Связи арил-кислород устойчивы, расщепляются связи алкил-кислород:
`$C_6H_5-O-CH_2-O-C_6H_5 + 2HI \rightarrow 2C_6H_5OH + CH_2I_2$`
Вещество `$X_5$` – смесь фенола (`$C_6H_5OH$`) и дииодметана (`$CH_2I_2$`).
Цепочка 2 (получение `$X_6$`):
4. `$X_2$` – это фенолят натрия (`$C_6H_5ONa$`). Его обрабатывают кислотой (HBr) для получения фенола. Обозначение `(p-p)` неясно, возможно, означает "протонирование".
`$C_6H_5ONa (X_2) + HBr \rightarrow C_6H_5OH (X_4) + NaBr$`
Вещество `$X_4$` – фенол (`$C_6H_5OH$`).
5. Реакция фенола с избытком бромной воды. Фенол как активированный арен легко бромируется в орто- и пара-положения:
`$C_6H_5OH + 3Br_2 \xrightarrow{H_2O} C_6H_2Br_3OH (X_6) + 3HBr$`
Вещество `$X_6$` – 2,4,6-трибромфенол (выпадает в виде белого осадка).
Ответ: `$X_1$` – `$C_6H_5ONa$` (фенолят натрия), `$X_2$` – `$C_6H_5ONa$` (фенолят натрия), `$X_3$` – `$C_6H_5-O-CH_2-O-C_6H_5$` (бис(фенокси)метан), `$X_4$` – `$C_6H_5OH$` (фенол), `$X_5$` – смесь `$C_6H_5OH$` (фенол) и `$CH_2I_2$` (дииодметан), `$X_6$` – `$C_6H_2Br_3OH$` (2,4,6-трибромфенол).
ж)* `$C_2H_6O \rightarrow X \rightarrow C_4H_{10} \rightarrow Y \rightarrow C_3H_6O_2 \rightarrow Z \rightarrow C_2H_6O$`
Решение
Это циклическая схема превращений. Исходное и конечное вещество `$C_2H_6O$` – этанол (`$CH_3CH_2OH$`).
1. Получение из этанола галогеналкана для последующего удвоения цепи по реакции Вюрца:
`$CH_3CH_2OH + HBr \rightarrow CH_3CH_2Br (X) + H_2O$`
Вещество `$X$` – бромэтан (`$C_2H_5Br$`).
2. Реакция Вюрца для получения бутана:
`$2CH_3CH_2Br + 2Na \rightarrow CH_3CH_2CH_2CH_3 (C_4H_{10}) + 2NaBr$`
Вещество с формулой `$C_4H_{10}$` – н-бутан.
3. Для перехода к C3-соединению необходимо укоротить цепь. Это достигается крекингом бутана:
`$CH_3CH_2CH_2CH_3 \xrightarrow{t, kat} CH_3-CH=CH_2 (Y) + CH_4$`
Вещество `$Y$` – пропен (`$C_3H_6$`).
4. Получение пропановой кислоты (`$C_3H_6O_2$`) из пропена. Это можно осуществить, например, карбонилированием (реакция Реппе):
`$CH_3-CH=CH_2 + CO + H_2O \xrightarrow{kat, p, t} CH_3CH_2COOH (C_3H_6O_2)$`
Вещество `$C_3H_6O_2$` – пропановая кислота.
5. Для перехода от C3-кислоты к C2-спирту можно использовать перегруппировку Гофмана для укорочения цепи на один атом углерода:
`$CH_3CH_2COOH \xrightarrow{1.SOCl_2; 2.NH_3} CH_3CH_2CONH_2 \xrightarrow{Br_2, NaOH} CH_3CH_2NH_2 (Z)$`
Вещество `$Z$` – этиламин (`$C_2H_5NH_2$`).
6. Превращение первичного амина в спирт действием азотистой кислоты:
`$CH_3CH_2NH_2 + HNO_2 \rightarrow CH_3CH_2OH (C_2H_6O) + N_2\uparrow + H_2O$`
Таким образом, цикл замыкается на этаноле.
Ответ: `$C_2H_6O$` – `$CH_3CH_2OH$` (этанол), `$X$` – `$CH_3CH_2Br$` (бромэтан), `$C_4H_{10}$` – `$CH_3CH_2CH_2CH_3$` (н-бутан), `$Y$` – `$CH_3-CH=CH_2$` (пропен), `$C_3H_6O_2$` – `$CH_3CH_2COOH$` (пропановая кислота), `$Z$` – `$CH_3CH_2NH_2$` (этиламин).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 752 расположенного на странице 171 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №752 (с. 171), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














